
| m2g |
| 233g/mol |
| m2 |
| 233 |
| 1 |
| 2 |
| m2 |
| 233 |
| 237m2 |
| 233 |
| ||
| mg |
| 23700m2 |
| 233m |
| 23700m2 |
| 233m |


 口算题卡加应用题集训系列答案
口算题卡加应用题集训系列答案 综合自测系列答案
综合自测系列答案科目:高中化学 来源: 题型:

| 23700m2 |
| 233m |
| 23700m2 |
| 233m |
查看答案和解析>>
科目:高中化学 来源: 题型:

| 23700m2 |
| 233m |
| 23700m2 |
| 233m |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:
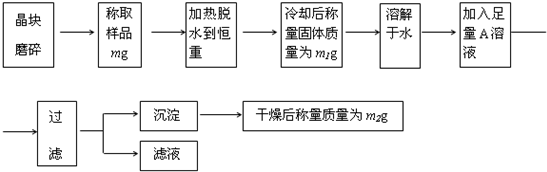
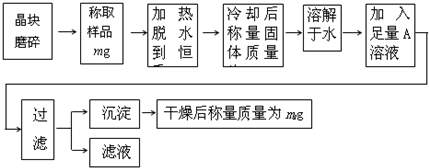
为了测定混有少量KCl杂质的明矾KAl(SO4)2·nH2O的纯度,同时测定n的值,按下列流程进行实验:

(1)称量样品需用托盘天平,下列有关使用托盘
天平的叙述,不正确的是 ( ).
A、称量前先调节托盘天平的零点
B、称量时左盘放被称量物,右盘放砝码
C、潮湿的或具有腐蚀性的药品,必须放在玻璃器皿里称量,其他固体药品可直接放在天平托盘上称量
D、用托盘天平可以准确称量至0.01克
E、称量完毕,应把砝码放回砝码盒中
(2)判断已脱水至恒重的方法是( )
A、长时间加热 B、两次称量的质量必须一样
C、观察有水蒸气不再冒出 D、两次称量的质量差不超过0.1g
(3)在加热结束后,冷却固体的操作为 ;
(4)A溶液是 (填化学式),判断A溶液是否足量的方法是
;
(5)通过实验,测得明矾化学式中n值为12,则明矾的纯度为 %。
(已知KAl(SO4)2·12H2O的式量为474)
查看答案和解析>>
科目:高中化学 来源:2011年浙江省高考化学模拟试卷(六)(解析版) 题型:解答题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com