
����Ŀ��ijͬѧͨ������װ�òⶨM��Ʒ��ֻ��![]() ��
��![]() ��
��![]() ���и��ɷֵ�����������ȡ����������Ϊ
���и��ɷֵ�����������ȡ����������Ϊ![]() ��M��Ʒ����ʵ��1����ͼ1����ʵ��2����ͼ2������ʵ�飬��ͬѧ˳�������ʵ�鲢�����������ֱ�Ϊ
��M��Ʒ����ʵ��1����ͼ1����ʵ��2����ͼ2������ʵ�飬��ͬѧ˳�������ʵ�鲢�����������ֱ�Ϊ![]() ��
��![]() �������㵽��״���£���
�������㵽��״���£���
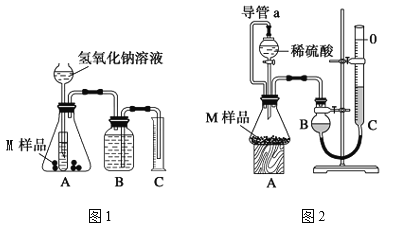
��1����ʵ��������ϡ��������98����Ũ����![]() ���Ƶģ����Ũ��������ʵ���Ũ����______
���Ƶģ����Ũ��������ʵ���Ũ����______![]() ��
��
��2��д��ʵ��1�п��ܷ�����Ӧ�����ӷ���ʽ��____________________________________��
��3������ʵ��2��ƽ�Ӷ���ǰӦ���ν��е����ֲ����ǣ���____________����____________��
��4��M��Ʒ��ͭ��������������ѧ����ʽΪ����![]() ��
��![]() ��ʾ����________________________��
��ʾ����________________________��
��5����ʵ����Ҫ![]() ��
��![]() ��Һ
��Һ![]() ����ش��������⣺
����ش��������⣺
������ʱӦ����______![]() ��
��
������![]() ��Һʱ��
��Һʱ��![]() �����к���
�����к���![]() ���ʻᵼ��������ҺŨ��______�����ƫ����ƫС������Ӱ�족����ͬ����
���ʻᵼ��������ҺŨ��______�����ƫ����ƫС������Ӱ�족����ͬ����
��6������ȥʵ��2�е���a��ʹ����������______��ʵ��1����ʵ��ǰ��Bƿ��ˮû��װ����ʹ����������______��
���𰸡�18.4 2Al+2OH��+2H2O=2AlO2��+3H2�� ��ȴ������ ����BCҺ����ƽ ![]() ��
��![]() 10.0 ƫ�� ƫ�� ��Ӱ��
10.0 ƫ�� ƫ�� ��Ӱ��
��������
�����⣬Mֻ����������ͭ���ֽ�����������������ǿ�ᷴӦ��������ǿ�Ӧ����ֻ������ǿ�ᣬ������ǿ�ͭ�Ȳ������������ƣ�Ҳ������ϡ������
��1������![]() �����Ũ��������ʵ���Ũ�ȣ�
�����Ũ��������ʵ���Ũ�ȣ�
��2��ʵ��1������������Һֻ������Ӧ��
��3������ʵ��2��ƽ�Ӷ���ǰӦ�ȵ���ȴ�����£��������ƶ�C�����ܣ�ʹB��CҺ����ƽ����Ŀ����ʹB���ռ�������ѹǿ����������ѹ���������õĶ�����ȷ��
��4������V1�ɼ������Ʒ�����������������������ᷴӦ�������������Ը���V2��V1��Ϊ�������ᷴӦ���ɵ������������������ٽ�һ������ͭ���������Ӷ������ͭ������������
��5����Ҫ����0.50molL��1��NaOH��Һ480mL����������ƿӦΪ500mL�����Լ����������Ƶ�����ʱҪ��500mL��Һ���㣻
��NaOH�����к���Na2O���ʣ���������ˮ�������Ϸ�Ӧ�����������ƣ�ʹ����Һ����������ƫ�࣬�ݴ˴��⣻
��6������ȥʵ��2�е���a������Һ��ʱ���ų���ƿ�в��ֿ��������²ⶨ���������ƫ�������ʵ��1ʵ��ǰBƿҺ��û��װ��ˮ����Ӱ��ʵ��������Ϊ������B���ռ������������������C����Һ��������
��1������![]() �ɵ�Ũ��������ʵ���Ũ��Ϊ
�ɵ�Ũ��������ʵ���Ũ��Ϊ![]() ��
��
��2��ʵ��1������������Һֻ������Ӧ����Ӧ�����ӷ���ʽΪ��2Al+2OH��+2H2O=2AlO2��+3H2����
��3������ʵ��2��ƽ�Ӷ���ǰӦ�ȵ���ȴ���������������ƶ�C�����ܣ�ʹB��CҺ����ƽ����Ŀ����ʹB���ռ�������ѹǿ����������ѹ���������õĶ�����ȷ��
��4������V1��������������Ƶķ�Ӧ��֪��Ʒ����������Ϊ![]() �������������ᷴӦ�������������Ը���V2-V1��Ϊ�������ᷴӦ���ɵ�������������Ʒ����������Ϊ
�������������ᷴӦ�������������Ը���V2-V1��Ϊ�������ᷴӦ���ɵ�������������Ʒ����������Ϊ![]() ��������Ʒ��ͭ�ĺ���Ϊ
��������Ʒ��ͭ�ĺ���Ϊ![]() =mg-
=mg-![]() ����ͭ�����������ı���ʽΪ��
����ͭ�����������ı���ʽΪ��![]() ��
��![]() ��
��
��5����Ҫ����0.50molL��1��NaOH��Һ480mL����������ƿӦΪ500mL����������ʱӦ����0.50molL��1��0.5L��40g/mol=10.0g NaOH��
��NaOH�����к���Na2O���ʣ���ͬ����ʱ����������ˮ��Ӧ���ɸ�����������ƣ�ʹ����Һ����������ƫ�࣬���Իᵼ��������ҺŨ��ƫ����
��6������ȥʵ��2����a������Һ��ʱ���ų���ƿ�в��ֿ��������²ⶨ���������ƫ�����ʵ��1ʵ��ǰBƿҺ��û��װ��ˮ����Ӱ��ʵ��������Ϊ������B���ռ������������������C����Һ��������



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij��Һ�п��ܺ���![]() ��
��![]() ��
��![]() ��
��![]() ��
��![]() �ֱ�ȡ����
�ֱ�ȡ����![]() �����Һ�������ԣ�
�����Һ�������ԣ�![]() �μ���ˮ�͵�����������ʼ������������Ϊȷ������Һ����ɣ�����ļ��鷽�����Լ���
�μ���ˮ�͵�����������ʼ������������Ϊȷ������Һ����ɣ�����ļ��鷽�����Լ���
A. ��ɫ��Ӧ B. NaOH��Һ�����ȣ�
C. ![]() �ữ
�ữ![]() ��Һ D.
��Һ D. ![]() ����
����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���绯ѧԭ���ڷ�ֹ������ʴ������ת�������ʺϳɵȷ���Ӧ�ù㷺��

��1��ͼ1�У�Ϊ�˼�����ˮ�Ը�բ��A�ĸ�ʴ������B����ѡ��__________������ĸ��ţ�
a��̼�� b��п�� c��ͭ��
�õ绯ѧԭ�����Ͳ���B�趨�ڲ�ԭ��_______________��


��2��þȼ�ϵ���ڿ��ƶ������豸��Դ�ͱ��õ�Դ�ȷ���Ӧ��ǰ��������ͼ2Ϊ��þ������������ȼ�ϵ��ԭ��ʾ��ͼ���缫Ϊþ�Ͻ�Ͳ��Ͻ�
��EΪ��ȼ�ϵ�ص�_____________������������������������F�缫�ϵĵ缫��ӦʽΪ_____________��
��þȼ�ϵ�ظ����������Ը�ʴ����������ʹ���������ʽ��ͣ��û�ѧ���������ԭ��____________��
��3����ȩ�ᣨHOOC-CHO�����л��ϳɵ���Ҫ�м��塣��ҵ������˫���ҳɶԵ�ⷨ��������ȩ�ᣬԭ����ͼ3��ʾ����װ��������������Ϊ���Ե缫�������Ҿ��ɲ�����ȩ�ᣬ�����Ҷ�ȩ��M�缫�IJ��ﷴӦ������ȩ�ᡣ
��N�缫�ϵĵ缫��ӦʽΪ______________��
������2molH+ͨ�����ӽ���Ĥ������ȫ�����˷�Ӧ�����װ�������ɵ���ȩ��Ϊ________________mol��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij��Һ�к�![]() ��
��![]() ��
��![]() ����������εμ�
����������εμ�![]() ��
��![]() ��Һ�����������й�ϵͼ����ȷ����
��Һ�����������й�ϵͼ����ȷ����
A.  B.
B. 
C.  D.
D. 
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����1��ijͬѧΪ̽������KMnO4��Һ��H2C2O4�����ᣬ��Ԫ���ᣩ��Һ�ķ�Ӧ���̣���������ʵ�顣������������⣺
��д������KMnO4��Һ��H2C2O4�����ӷ���ʽ___________________________________��
������100mL0.0400mol��L-1��H2C2O4��Һ�����õ�������ƽ��ҩ�ס��ձ�����Ͳ���������������⣬�������õ��IJ���������_______________________________________��
�۽�KMnO4��Һ��ε���һ�����������H2C2O4��Һ�У��¶���ͬ����������¼���������£�
����KMnO4��Һ�Ĵ��� | KMnO4��Һ��ɫ��ȥ�����ʱ�� |
�ȵ����1�� | 60s |
��ɫ���ٵ����2�� | 15s |
��ɫ���ٵ����3�� | 3s |
��ɫ���ٵ����4�� | 1s |
�����KMnO4��Һ��ɫʱ��仯�Ŀ���ԭ��___________________________________��
��2��![]() ��
��![]() ����Һ�п��ת���������£���ʼŨ��Ϊ1.0 mol��L-1��Na2CrO4��Һ��
����Һ�п��ת���������£���ʼŨ��Ϊ1.0 mol��L-1��Na2CrO4��Һ��![]() ��c(H+)�ı仯��ͼ��ʾ
��c(H+)�ı仯��ͼ��ʾ

�������ӷ���ʽ��ʾ��Һ��![]() ��
��![]() ��ת����Ӧ_________��
��ת����Ӧ_________��
����ͼ��֪����Һ���Լ�С�� ![]() ��ƽ��ת����_________���������С�����䡱����
��ƽ��ת����_________���������С�����䡱����
�������¶ȣ���Һ��![]() ��ƽ��ת���ʼ�С����÷�Ӧ�Ħ�H_________0������ڡ���С�ڡ����ڡ�����
��ƽ��ת���ʼ�С����÷�Ӧ�Ħ�H_________0������ڡ���С�ڡ����ڡ�����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ijͬѧ����������ԭ��Ӧ��2KMnO4��10FeSO4��8H2SO4=2MnSO4��5Fe2(SO4)3��K2SO4 ��8H2O�������ԭ��أ�������װ�б���KCl��Һ������˵����ȷ����

A. b�缫�Ϸ�����ԭ��Ӧ
B. ���·���ӵ������Ǵ�a��b
C. ��ع���ʱ�������е�SO42��������ձ�
D. a�缫�Ϸ����ķ�ӦΪ��MnO4����8H����5e�� = Mn2����4H2O
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��һ�ִ��Բ��ϵ�ĥ�����ϣ�������������Լ21%����Ҫ�ɷ��������Ͻ𣬻�����ͭ���ơ�þ�����������ɸ÷����Ʊ����Ƚϸߵ�����������������������

�ش��������⣺
��1����������ʱ����Һ����Fe3����Fe2����Ni2�������ɣ���������Ҫ�ɷ���__________���������ܽ�����ӷ���ʽΪ__________________________________________��
��2����������ʱH2O2��������___________________������̼���Ƶ�Ŀ����__________________________________________��
��3������ͭ��ʱ����Ӧ�����ӷ���ʽΪ_____________________________________������Na2S����H2S��ͭ���ŵ���__________��
��4����֪����þ�������մ������н��У�NaF��ʵ���������ܹ��������Ϊ_____________________��
��5����֪������Ksp[Ni(OH)2]=2.0��10��15�������������������������������ҺpHԼΪ_______��Ni2���Ÿպó�����ȫ�����ӳ�����ȫ��Ũ����10��5 mol/L��lg2=0.30��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij��ѧ����С������ʵ���ʾ��ͼ��ͼ��ʾ��ͼ�С�������ʾ�������� M��һ�ִ�������������壬YΪ��һ�����壬E���к���ɫ���������ʵ����������ֻ��������������ѡȡ��Na2CO3��Na2O2��NaCl��Na2O��CaCl2��(NH4)2CO3����ʯ�ҵȹ��弰����ˮ���ݴ�ʵ�飬���������գ�

(1)A������װ�õ���Ҫ������ҩƷ��______________________��
(2)B����ѡ�ĸ������________����������______________________________��
(3)C�з�������Ҫ��Ӧ�Ļ�ѧ����ʽ��________________________________��
(4)��ȡY�����Dװ�����õ���Ҫ������__________________________��
��ȡY����Ļ�ѧ����ʽ��________________________��
(5)F�з�����Ӧ�Ļ�ѧ����ʽΪ__________________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������ϩ����Ȳ��������ԭ�ش���������:
��1���л���![]() ��ϵͳ����Ϊ______________��ʹ���ڴ���������������ȫ�⻯������������ϵͳ����Ϊ______________��
��ϵͳ����Ϊ______________��ʹ���ڴ���������������ȫ�⻯������������ϵͳ����Ϊ______________��
��2���л���![]() ��ϵͳ����Ϊ_____________��ʹ���ڴ���������������ȫ�⻯������������ϵͳ����Ϊ_____________��
��ϵͳ����Ϊ_____________��ʹ���ڴ���������������ȫ�⻯������������ϵͳ����Ϊ_____________��
��3���л���2-��-2-��ϩ�Ľṹ��ʽΪ_________��
��4��ijϩ���Ĵ���������2-��-4-�һ�-2-��ϩ����������ȷ������__________��
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com