
| A. | 若两烧杯中铝粉均已完全溶解,则两烧杯中放出氢气的量相同 | |
| B. | 若两烧杯中铝粉均未完全溶解,则盛氢氧化钠溶液的烧杯中放出氢气的量更多 | |
| C. | 若反应后,有一个烧杯中铝粉完全溶解,另一个烧杯中铝粉没有完全溶解,则那个还有铝没有溶解的烧杯原来盛着的是氢氧化钠溶液 | |
| D. | 无论如何,盐酸与铝粉反应产生的H2不可能比氢氧化钠溶液与铝粉反应产生的H2多 |
分析 根据铝的质量相同,盐酸和氢氧化钠溶液中溶质的物质的量相同,由化学反应方程式2Al+6H+═2Al3++3H2↑、2Al+2NaOH+2H2O═2NaAlO2+3H2↑分析氢气的物质的量和铝与酸之间的关系,以此来计算解答.
解答 解:A、由反应2Al+6H+═2Al3++3H2↑、2Al+2NaOH+2H2O═2NaAlO2+3H2↑可知,参加反应的铝相等,生成氢气的量相等,故A正确;
B、由反应2Al+6H+═2Al3++3H2↑、2Al+2NaOH+2H2O═2NaAlO2+3H2↑可知,生成等物质的量的氢气,消耗盐酸多,所以若两烧杯中铝粉均未完全溶解,则盛氢氧化钠溶液的烧杯中放出氢气的量更多,故B正确;
C、由反应2Al+6H+═2Al3++3H2↑、2Al+2NaOH+2H2O═2NaAlO2+3H2↑可知,等物质量的盐酸和氢氧化钠,氢氧化钠消耗铝多,所以那个还有铝没有溶解的烧杯原来盛着的是盐酸,而不是氢氧化钠溶液,故C错误;
D、由反应2Al+6H+═2Al3++3H2↑、2Al+2NaOH+2H2O═2NaAlO2+3H2↑可知,等物质量的盐酸和氢氧化钠,氢氧化钠消耗铝多,消耗铝越多生成氢气的量越多,故D正确;
故选C.
点评 本题考查Al的化学性质及利用化学反应方程式的计算,为高频考点,明确铝与酸、碱反应水的化学反应方程式,酸碱足量、酸碱均不足量时得到的氢气的关系是解答本题的关键.


科目:高中化学 来源: 题型:解答题
| 元素编号 | 元素性质或原子结构 |
| B | 短周期主族元素中原子半径最大 |
| C | 单质为双原子分子,是空气的主要成分,化学性质稳定 |
| D | 元素最高正价是+7价 |
| E | M层上有6个电子 |
 ;元素E与元素D相比,非金属性较强的是Cl(用元素符号表示),下列实验能证明这一事实的是B(填序号).
;元素E与元素D相比,非金属性较强的是Cl(用元素符号表示),下列实验能证明这一事实的是B(填序号).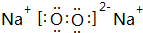 ,其中含有离子、非极性键(填“离子”、“极性”或“非极性”);该化合物加入FeCl2溶液中,产生红褐色沉淀,但无气体产生,试写出该反应的离子方程式3Na2O2+6Fe2++6 H2O=4Fe(OH)3+2Fe3++6Na+.
,其中含有离子、非极性键(填“离子”、“极性”或“非极性”);该化合物加入FeCl2溶液中,产生红褐色沉淀,但无气体产生,试写出该反应的离子方程式3Na2O2+6Fe2++6 H2O=4Fe(OH)3+2Fe3++6Na+.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 铁制品表面镀锌可以增强其抗腐蚀性 | |
| B. | 在海轮外壳上连接锌块保护外壳不受腐蚀是采用了牺牲阳极的阴极保护法 | |
| C. | 马口铁(镀锡)外层镀层被破坏后,里面的铁更易被腐蚀 | |
| D. | 利用外加电流的阴极保护法,可以将水下的钢闸门与电源正极相连 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
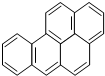 ,它是一种稠环芳香烃,其化学式为C20H12,此物质中碳元素和氢元素的质量比为20:1.
,它是一种稠环芳香烃,其化学式为C20H12,此物质中碳元素和氢元素的质量比为20:1.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
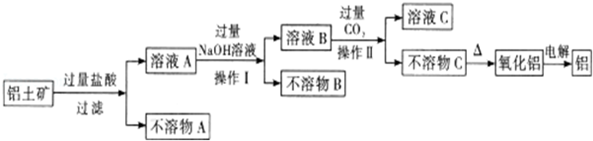
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NO3- | B. | Cu2+ | C. | Mg2+ | D. | Ba2+ |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
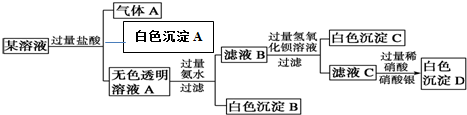
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1.6mol | B. | 大于1.2 mol | C. | 大于1.6 mol | D. | 小于1.2 mol |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
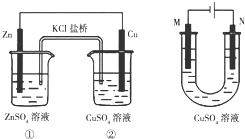
| A. | 装置①将电能转变为化学能 | |
| B. | 装置①中盐桥内的Cl-移向ZnSO4溶液 | |
| C. | 若装置②用于铁棒镀铜,则N极为铁棒 | |
| D. | 若装置②用于电解精炼铜,则溶液中的Cu2+浓度保持不变 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com