
| A. | 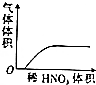 稀HNO3滴入Na2SO3溶液中 | B. | 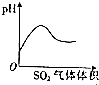 SO2气体通入新制氯水中 | ||
| C. | 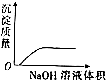 NaOH溶液滴入Ba(HCO3)2溶液中 | D. | 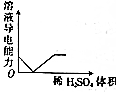 稀H2SO4滴入Ba(OH)2溶液中 |
分析 A.Na2SO3能被硝酸氧化为硫酸钠;
B.SO2与氯水反应生成硫酸和盐酸,溶液酸性增强;
C.NaOH与Ba(HCO3)2反应生成碳酸钡沉淀;
D.稀H2SO4与Ba(OH)2反应生成硫酸钡沉淀和水,溶液中离子浓度越大,导电性越强.
解答 解:A.Na2SO3能被硝酸氧化为硫酸钠,稀HNO3滴入Na2SO3溶液中不能生成SO2气体,故A错误;
B.SO2与氯水反应生成硫酸和盐酸,溶液酸性增强,则溶液的pH会减小,故B错误;
C.NaOH与Ba(HCO3)2反应生成碳酸钡沉淀,溶液中沉淀的质量逐渐增大,当二者恰好反应时沉淀质量最大,继续加氢氧化钠,沉淀的质量不再改变,故C正确;
D.稀H2SO4与Ba(OH)2反应生成硫酸钡沉淀和水,溶液中离子浓度越大,导电性越强,当二者恰好反应时溶液中离子浓度最小,导电性最差,但是导电能力不会为0,故D错误.
故选C.
点评 本题考查了元素化合物的性质、溶液的导电性等,题目难度不大,把握有关物质之间的反应以及影响溶液导电性的因素是解题的关键.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:解答题
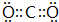 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 16g CH4中含有4NA个C-H键 | |
| B. | 一定条件下,氨与氧气在催化剂作用下反应生成30g NO,转移电子数为5NA个 | |
| C. | 常温常压下,13.8g NO2与水充分反应,产生0.1N A个NO分子 | |
| D. | 标准状况下,22.4 LCCl4中含有N A个CCl4分子 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 11:1 | B. | 9:2 | C. | 1:11 | D. | 2:9 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 化学反应 | 焓变 | 平衡常数 | 温度/℃ | ||
| 500 | 700 | 800 | |||
| ①2H2(g)+CO(g)?CH3OH(g) | △H1 | K1 | 2.5 | 0.34 | 0.15 |
| ②CO2(g)+H2(g)?CO(g)+H2(g) | △H2 | K2 | 1.0 | 1.70 | 2.52 |
| ③CO2(g)+3H2(g)?CH3OH(g)+H2(g) | △H3 | K3 | |||
| 容器 | 甲 | 乙 | 丙 | |
| 反应物投入量 | 1molCO 2mol H2 | 1mol CH3OH | 2mol CH3OH | |
| 平衡时数据 | CH3OH的浓度(mol/L) | C1 | C2 | C3 |
| 反应体系的能量变化 | aKJ | bKJ | cKJ | |
| 体系压强(Pa) | P1 | P2 | P3 | |
| 反应物转化率 | a1 | a2 | a3 | |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 烷烃的通式为CnH2n+2,随n值增大,碳元素的质量百分含量逐渐减小 | |
| B. | 乙烯与溴发生加成反应的产物为溴乙烷 | |
| C. | n=7,主链上有5个碳原子的烷烃共有五种 | |
| D. | 1mol苯恰好与3mol氢气完全加成,说明一个苯分子中有三个碳碳双键 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com