
����Ŀ��һ���¶�����ij�����м���������̼�����������ӦCaCO3(s)![]() CaO(s)+CO2(g)���ﵽƽ��������˵����ȷ����
CaO(s)+CO2(g)���ﵽƽ��������˵����ȷ����
A���������СΪԭ����һ�룬����ϵ�ٴδﵽƽ��ʱ��CO2��Ũ��Ϊԭ����2��
B��CaCO3(s)���ȷֽ�����CaO(s)��CO2(g)����S<0
C�����������Ϊԭ����2�����ٴδﵽƽ��ʱ��������ܶȱ�С
D����������������䣬����He��ƽ�����淴Ӧ�������
 �Ķ��쳵ϵ�д�
�Ķ��쳵ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ijͬѧ������������ȡ��������(��Ҫ�ɷ�ΪFe2O3��SiO2��Al2O3����������������)��ȡ��ˮ����������(FeSO4��7H2O)�����������������

����˵������ȷ����
A. �ܽ�����ѡ���������ᣬ�Լ�Xѡ������
B. ����1��һ������SiO2������pH��Ϊ��ʹAl3+ת��ΪA1(OH)3�������2
C. ���ı䷽��������Һ1��ֱ�Ӽ�NaOH���������õ��ij����������ܽ⣬����Һ���ᾧ����Ҳ�ɵõ�FeSO4��7H2O
D. ����Һ2�õ�FeSO4��7H2O��Ʒ�Ĺ����У������������ֹ�������ͷֽ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������ʵ���������ÿ�����þ��Ϊԭ����ȡ��������þ��Mg3N2)����֪ʵ���п��ܻᷢ�����з�Ӧ����2Mg+O2![]() 2MgO����3Mg+N2
2MgO����3Mg+N2![]() Mg3N2����2Mg+CO2
Mg3N2����2Mg+CO2![]() 2MgO+C����Mg+H2O
2MgO+C����Mg+H2O![]() MgO+H2������Mg3N2+6H2O
MgO+H2������Mg3N2+6H2O![]() 3Mg(OH)2+2NH3��
3Mg(OH)2+2NH3��
�ɹ�ѡ���װ�ú�ҩƷ��ͼ��ʾ��þ�ۡ���ԭ���۾��Ѹ��װ�����������ķ�Ӧ����ȫ�ģ�����װ�õ�ĩ����������������


�ش��������⣺
��1�������ʵ�鷽��ʱ����װ��A��E�⣬��Ӧѡ���װ�ã�����ĸ���ţ�����Ŀ�ķֱ���_____��
��2�����Ӳ����ʵ��װ�õ������ԡ�ʵ�鿪ʼʱ��������ˮ�Ŀ��أ���������5���Ĵ���ƿѹ�뷴Ӧװ�ã��������������ܵ�˳���ǣ�����ĸ���ţ�___��
��3��ͨ�������ͬʱ��ȼA��Fװ�õľƾ��ƣ���ʵ�����к�Ӱ�죿____��ԭ����____��
��4�������һ��ʵ�飬��֤�����ǵ���þ��___��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ˮ����(N2H4��H2O)����ɫ����ǿ��ԭ�Ե�Һ�壬ʵ�����Ƹ�ˮ���µ�ԭ��Ϊ��CO(NH2)2+2NaOH+NaC1O=Na2CO3+N2H4��H2O+NaCl �ݴˣ�ijѧ�����������ʵ�顣
����1���Ʊ�NaC1O��Һ����֪��3NaC1O![]() NaC1+NaC1O3
NaC1+NaC1O3

(1)���ռ��������30��NaOH��Һʱ�����貣����������Ͳ���_______(����ĸ)��
A������ƿ B���ձ� C����Һ�� D��������
(2)װ��A�з�����Ӧ�����ӷ���ʽ��__________����װ��C�г��ֶ�����������a�е�����Ϊ_______________��B���ñ�ˮԡ�����¶���30�����£�����ҪĿ����______________��
����2����ȡˮ���¡�
���Ʒ�Ӧ�¶ȣ�����Һ©���е���Һ��������������ƿ�У���ַ�Ӧ����������������ƿ�ڵ���Һ���ռ�108~114����֡�(��֪��N2H4��H2O+2NaC1O=N2��+3H2O+2NaC1)��
(3)��Һ©���е���Һ��___________(����A������B��)��
A��NaOH��NaC1O�����Һ B��CO(NH2)2��Һ

����3���µ����ʷ�����ⶨ��
(4)ˮ�����백ˮ�������ƣ����ڶ�Ԫ���ˮ���������ᷴӦ���������λ�ѧʽΪ_______________��
(5)ˮ���¾��л�ԭ�ԣ����������ɵ�������ȡ���0.3000g����ˮ��ɼ�20.00mL��Һ��һ����������0.1500 mol/L��I2��Һ�ζ���
��ˮ���������Һ��Ӧ�Ļ�ѧ����ʽΪ_______________________________________��
��ʵ��������I2��Һ��ƽ��ֵΪ20.00mL�������N2H4��H2O����������Ϊ__________��(������λ��Ч����)
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����S2����Fe2+��Br����I����0.1mol����Һ��ͨ���״���µ�Cl2��ͨ��Cl2���������Һ��������ӵ����ʵ�����ϵͼ��ȷ���ǣ�������
A.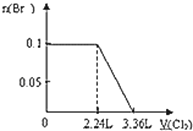 B.
B.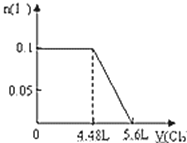
C.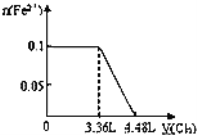 D.
D.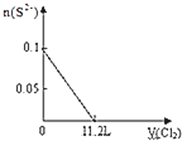
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����÷���м(��Ҫ�ɷ�ΪFe��������C��S��P��)��ȡ��Ч��ˮ��K2FeO4������ͼ��

����˵������ȷ����
A. ����м������ǰ�����ȵĴ�����Һȥ����
B. ������ǽ�Fe2+ת��ΪFe(OH)3
C. ������з����ķ�Ӧ�����ӷ���ʽΪ2Fe(OH)3+3ClO-==2FeO42-+3Cl-+4H++H2O
D. ������з�Ӧ�ܷ�����ԭ��������ͬ�����£�K2FeO4���ܽ��С��Na2FeO4
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���ҹ�����ר�Һ�°�ġ������Ƽ����Ϊ�����Ƽҵ������ͻ�����ף����Ա���ʳ��ˮ��NH3��CO2Ϊԭ�����Ƶ�NaHCO3����������������ش��������⣺
ij̽���С����������Ƽ�ԭ��������̼�����Ƶ��Ʊ�ʵ�飬ͬѧ�ǰ�������Ʒ���ʵ�顣һλͬѧ��������̼����ͨ�뺬���ı���ʳ��ˮ���Ʊ�̼�����ƣ�ʵ��װ����ͼ��ʾ(ͼ�мг֡��̶��õ�����δ����)
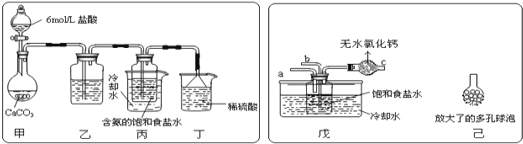
��1����װ����ϡ�����������____��
��2����һλͬѧ��ͼ����װ�ã�����װ��δ����������ʵ�顣ʵ��ʱ�����ȴ�___��ͨ��NH3���塣
��3����ͬѧ��������װ�õ�b���¶����Ӽ�װ�ã�������_____��
��4����������г�������������ڲ�ͬ�¶��µ��ܽ�����ݣ�g/100gˮ����
0�� | 10�� | 20�� | 30�� | 40�� | 50�� | |
NaCl | 35.7 | 35.8 | 36.0 | 36.3 | 36.6 | 37.0 |
NaHCO3 | 6.9 | 8.1 | 9.6 | 11.1 | 12.7 | 14.5 |
NH4Cl | 29.4 | 33.3 | 37.2 | 41.4 | 45.8 | 50.4 |
���ձ������ݣ������������װ����ʹ����ȴˮ���߱�ˮ��ԭ��____��
��5����С��ͬѧΪ�˲ⶨ�������þ����̼�����ƵĴ��ȣ����辧���в���̼�������ʣ����������ָ����������Ϊag���ٽ�������ȵ��������ٱ仯ʱ���������÷�ĩ����Ϊmg��Ȼ�������ͼ��ʾʵ�飺
![]()
���ڲ������У�Ϊ���жϼ����Ȼ�����Һ�Ƿ������������ȷ����___������ĸ����
a �ڼ����Ȼ�����Һ�������ã�����Һ�м������������Ȼ�����Һ
b �ڼ����Ȼ�����Һ�������ã�����Һ���ټ�������̼������Һ
c �ڼ����Ȼ�����Һ�������ã�ȡ�ϲ���Һ�ټ�������̼������Һ
�����þ�����̼�����ƵĴ���Ϊ___��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��Ϊ��ǿ������ʴ�ԣ�����Ǧ����Ϊ���Դ����Al��������Pb�����������ϡ���ᣬʹ�����������Ĥ�����䷴Ӧԭ�����£� ��أ� Pb(s) + PbO2(s) + 2H2SO4(aq) =2PbSO4(s) + 2H2O(l)��
���أ�2Al+3O2![]() Al2O3+3H2���������У������ж���ȷ���ǣ� ��
Al2O3+3H2���������У������ж���ȷ���ǣ� ��
��� | ���� | |
A | H+����Pb�缫 | H+����Pb�缫 |
B | ÿ����3molPb | ����2molAl2O3 |
C | ������PbO2+4H++2e��=Pb2++2H2O | ������2Al+3H2O-6e��=Al2O3+6H+ |
D |
|
|
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������ƾ��壨Na2MoO4��2H2O��������������ȼ������������ˮϵͳ�Ľ������Ƽ�����ͼ�������⾫����Ҫ�ɷ���MoS2��������PbS�ȣ�Ϊԭ�����������ƾ���Ĺ�������ͼ��
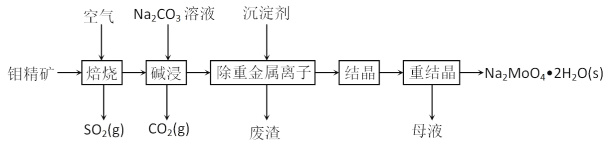
�ش��������⣺
��1����߱���Ч�ʵķ�����_______________________����дһ�֣�
��2����������ʱMoS2ת��ΪMoO3���÷�Ӧ���̵Ļ�ѧ����ʽΪ____________________������������__________________
��3���������ʱ����CO2�ĵ���ʽΪ______________�������ʱ���⻯���������Ҫ��Ӧ�����ӷ���ʽΪ____________________________��
��4���������ؽ���������ʱ����ij�����ΪNa2S��������ɷֵĻ�ѧʽΪ____________________��
��5���⾫�������������£�����NaNO3��Һ��Ҳ�����Ʊ������ƣ�ͬʱ��SO42-���ɣ��÷�Ӧ�����ӷ���ʽΪ____________________________________________________________��
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com