
海水是宝贵的资源宝库,目前氯碱工业、海水提镁、海水提溴为人类提供了大量工业原料。下图是海水综合利用的部分流程图,据图回答问题:
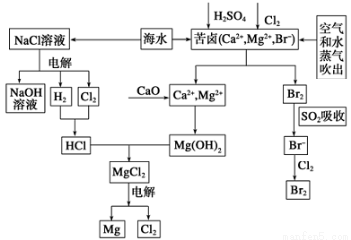
(1)由海水晒制的粗盐中含 有Ca2+、Mg2+、SO42-等离子,为除去这些离子,所加试剂及其先后顺序为(写化学式) ___________________。
有Ca2+、Mg2+、SO42-等离子,为除去这些离子,所加试剂及其先后顺序为(写化学式) ___________________。
(2)①电解饱和食盐水的化学反应方程式为______________。
②制取MgCl2的过程中涉及反应:MgC l2·6H2O
l2·6H2O MgCl2+6H2O,该反应要在HCl气氛中进行,原因是_______________。
MgCl2+6H2O,该反应要在HCl气氛中进行,原因是_______________。
(3)苦卤中通入Cl2置换出Br2,吹出后用SO2吸收,写出用SO2吸收发生的离子方程式_________,由此判断Cl2、Br2、SO2的氧化性由强到弱的顺序为__________________。
(4)也有工艺是在吹出Br2后用碳酸钠溶液吸收,形成溴化钠和溴酸钠,同时有CO2放出。该反应的离子方程式是_____________;最后再用H2SO4处理得到Br2,之后加入CCl4进行Br2的萃取,最终用_____________方法得到单质Br2。
 字词句篇与同步作文达标系列答案
字词句篇与同步作文达标系列答案科目:高中化学 来源:2016-2017陕西西安长安区一中实验班高一12月考化学卷(解析版) 题型:推断题
氢能源是一种重要的清洁能源。现有两种可产生H2的化合物甲和乙。将 6.00 g 甲加热至完全分解,只得到一种常见金属单质和 6.72 L 的 H2(已折算成标准状况)。甲与水反应也能放出H2,同时还产生一种白色沉淀物,该白色沉淀既可以溶于盐酸,也可溶于 NaOH 溶液。化合物乙在催化剂存在下可分解得到H2 和另一种单质气体丙,丙在标准状况下的密度为1.25 g·L-1。请回答下列问题:
(1)甲是_______________;乙是______________。( 填化学式)
(2)甲与水反应的化学方程式是____________。
(3)气体丙的分子式是____________。
(4)乙在加热条件下可与 CuO 发生反应,生成红色固体和气体丙,写出该反应的化学方程式________________。
(5)有人提出产物Cu中可能还混有Cu2O,请设计实验方案验证:__________________。
(已知:Cu2O+2H+=Cu+Cu2++H2O;Cu、Cu2O 均可以溶解在 HNO3 溶液中)
(6)甲与乙之间_____________ (填“可能”或“不可能”)发生反应产生H2,判断理由是_______________。
查看答案和解析>>
科目:高中化学 来源:2016-2017学年浙江省高二上期中化学试卷(解析版) 题型:选择题
已知反应2CH3OH(g) CH3OCH3(g)+H2O(g)某温度下的平衡常数为400。此温度下,在体积恒定的密闭容器中加入一定量的CH3OH,反应到某时刻测得各组分的浓度如下:
CH3OCH3(g)+H2O(g)某温度下的平衡常数为400。此温度下,在体积恒定的密闭容器中加入一定量的CH3OH,反应到某时刻测得各组分的浓度如下:
物质 | CH3OH | CH3OCH3 | H2O |
浓度/mol·L-1 | 0.44 | 0.6 | 0.6 |
下列叙述中正确的是 ( )
A.该反应的平衡常数表达式为K=[c(CH3OCH3)×c(H2O)]/c(CH3OH)
B.此时正、逆反应速率的大小:v正<v逆
C.若经10 min后反应达到平衡,此时c(CH3OH)=0.04 mol·L-1
D.0~10min内平均反应速率v(CH3OH)=1.6 mol·(L·min)-1
查看答案和解析>>
科目:高中化学 来源:2017届安徽马鞍山二中安师大附中高三12月联考化学卷(解析版) 题型:实验题
用铝土矿(含30% SiO2、40.8% Al2O3和少量Fe2O3等)制取铝硅合金材料有湿法、干法等方法,其中干法制备的工艺流程如下:
(1)若湿法处理铝土矿,用强酸浸取时,所得溶液中阳离子有 。
(2)焙烧除铁反应:4(NH4)2SO4 + Fe2O3  2NH4Fe(SO4)2 + 3H2O + 6NH3↑(Al2O3部分发生类似反应)。氧化物转化为硫酸盐的百分率与温度的关系如图,最适宜焙烧温度为 ,用电子式表示气体I的形成过程 。
2NH4Fe(SO4)2 + 3H2O + 6NH3↑(Al2O3部分发生类似反应)。氧化物转化为硫酸盐的百分率与温度的关系如图,最适宜焙烧温度为 ,用电子式表示气体I的形成过程 。

(3)操作①包括:加水溶解、 。
(4)用焦炭还原SiO2、Al2O3会产生中间体SiC、Al4C3。写一个高温下中间体与Al2O3反应生成铝单质的化学方程式 。
(5)铝硅合金材料中若含铁,会影响其抗腐蚀性。原因是 。
(6)不计损失,投入1t铝土矿,当加入54kg纯铝后,铝硅合金中m:n = 。
查看答案和解析>>
科目:高中化学 来源:2017届安徽马鞍山二中安师大附中高三12月联考化学卷(解析版) 题型:选择题
设NA表示阿伏加德罗常数的值。下列说法正确的是( )
A.1 molNaN3所含阴离子总数为3NA
B.0.1 mol氯化氢气体溶于水所得溶液中含有0.1 NA个HCl分子
C.标准状况下,22.4L C12通入到足量FeBr2溶液中,被氧化的Br-数目为2NA
D.32g O2和O3的混合气体含有的分子总数小于NA
查看答案和解析>>
科目:高中化学 来源:2017届重庆市西北狼教育联盟高三12月月考化学试卷(解析版) 题型:选择题
镁—次氯酸盐燃料电池的工作原理如右图所示,该电池反应为:Mg+ClO-+H2O=Mg(OH)2+Cl-
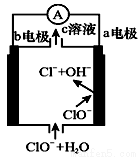
下列有关说法正确的是( )
A.电池工作时,c溶液中的溶质一定是MgCl2
B.负极反应式:ClO--2e-+H2O=Cl-+2OH-
C.电池工作时,OH-向b电极移动
D.b电极发生还原反应,每转移0.1 mol电子,理论上生成0.1 mol Cl-
查看答案和解析>>
科目:高中化学 来源:2017届江苏省淮安市高三12月考试化学试卷(解析版) 题型:填空题
氮的化合物合成、应用及氮的固定一直是科学研究的热点。
(1)以CO2与NH3为原料合成化肥尿素的主要反应如下:
①2NH3(g)+CO2(g)=NH2CO2NH4(s);ΔH=-159.47 kJ·mol-1
②NH2CO2NH4(s)=CO(NH2)2(s)+H2O(g);ΔH=a kJ·mol-1
③2NH3(g)+CO2(g)=CO(NH2)2(s)+H2O(g);ΔH=-86.98 kJ·mol-1
则a为 。
(2)反应2NH3(g)+CO2(g) CO(NH2)2(l)+H2O(g) 在合成塔中进行。下图1中Ⅰ、Ⅱ、Ⅲ三条曲线为合成塔中按不同氨碳比 [n(NH3)/n(CO2)]和水碳比[n(H2O)/n(CO2)]投料时二氧化碳转化率的情况。
CO(NH2)2(l)+H2O(g) 在合成塔中进行。下图1中Ⅰ、Ⅱ、Ⅲ三条曲线为合成塔中按不同氨碳比 [n(NH3)/n(CO2)]和水碳比[n(H2O)/n(CO2)]投料时二氧化碳转化率的情况。
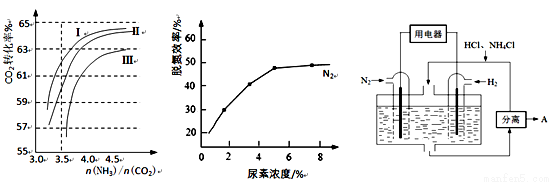
图1 图2 图3
①曲线Ⅰ、Ⅱ、Ⅲ水碳比的数值分别为:
A. 0.6~0.7 B. 1~1.1 C. 1.5~1.61
生产中应选用水碳比的数值为 (选填序号)。
②生产中氨碳比宜控制在4.0左右,而不是4.5的原因可能是 。
(3)尿素可用于湿法烟气脱氮工艺,其反应原理为:
NO+NO2+H2O=2HNO2;2HNO2+CO(NH2)2=2N2↑+CO2↑+3H2O。
①当烟气中NO、NO2按上述反应中系数比时脱氮效果最佳。若烟气中V(NO)∶V(NO2)=5∶1时,可通入一定量的空气,同温同压下,V(空气)∶V(NO)= (空气中氧气的体积含量大约为20%)。
②图2是尿素含量对脱氮效率的影响,从经济因素上考虑,一般选择尿素浓度约为 %。
(4)图3表示使用新型电极材料,以N2、H2为电极反应物,以HCl-NH4Cl为电解质溶液制造出既能提供能量,同时又能实现氮固定的新型燃料电池。请写出该电池的正极反应式 。生产中可分离出的物质A的化学式为 。
查看答案和解析>>
科目:高中化学 来源:2017届江苏省淮安市高三12月考试化学试卷(解析版) 题型:选择题
25℃时,下列各组离子在指定溶液中一定能大量共存的是
A.1.0 mol·L-1KNO3溶液:H+、Fe2+、SCN-、SO42-
B.c(H+)/ c(OH-)=10-10mol·L-1的溶液:K+、Ba2+、NO3-、Cl-
C.pH=0的溶液:Al3+、Cl-、SO42-、CO32-
D.c(ClO-) = 1.0 mol·L-1的溶液:Na+、I-、S2-、SO42-
查看答案和解析>>
科目:高中化学 来源:2017届吉林省高三上模拟四化学试卷(解析版) 题型:选择题
将n mol Cu2S 与足量的稀硝酸反应,生成硝酸铜、硫酸、一氧化氮和水,则参加反应的硝酸中被还原的硝酸的物质的量是
A.4n mol B.10n mol C.10n/3 mol D.2n/3 mol
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com