
| A. | 一个原子轨道上只能有一个电子 | |
| B. | 处在同一原子轨道上的电子运动状态完全相同 | |
| C. | 处在同一能级中的电子(基态)能量一定相同 | |
| D. | 处在同一电子层上的电子(基态)能量一定不同 |
科目:高中化学 来源: 题型:选择题
| A. | 难失去电子的原子,易形成阴离子 | |
| B. | 只有化合物分子中才存在共价键 | |
| C. | 共价分子中所有原子都具有8电子稳定结构 | |
| D. | 含氧酸的组成中可以含有金属元素 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
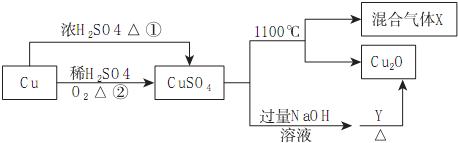
| A. | 途径①和途径②都体现了硫酸的酸性和氧化性 | |
| B. | Y可以是乙醛溶液 | |
| C. | CuSO4在1100℃分解所得气体X可能是SO2和SO3的混合气体 | |
| D. | 将CuSO4溶液蒸发浓缩、冷却结晶,可制得胆矾晶体 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
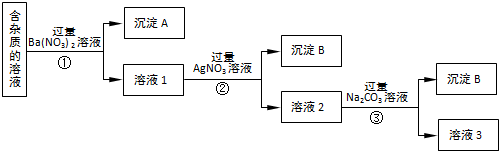
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 少量金属钠保存在煤油中 | |
| B. | 烧碱溶液盛装在带有玻璃塞的试剂瓶中 | |
| C. | 含有Fe3+的盐溶液遇KSCN 溶液变红 | |
| D. | 明矾(KAl(SO4)2•12H2O)可用作净水剂 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| K218O2的质量 | O2的叙述 | |
| A | 57g | O2的质量为9g |
| B | 57g | 生成标准情况下O2的体积为5.6L |
| C | 114g | O2的摩尔质量是32g•mol-1 |
| D | 57g | 生成0.25molO2 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 某无色透明的酸性溶液:Cl-、Na+、MnO4-、SO42- | |
| B. | 能使pH试纸变深蓝色的溶液:Na+、NH4+、K+、CO32- | |
| C. | 加入过量NaOH溶液后可得到澄清的溶液:K+、Ba2+、HCO3-、Cl- | |
| D. | 常温下pH=12的溶液:K+、Ba2+、Cl-、NO3- |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 向氢氧化钠溶液中滴加醋酸:H++OH-═H2O | |
| B. | 碳酸氢钙溶液中加入氢氧化钠溶液:HCO3-+OH-═CO32-+H2O | |
| C. | 用氢氧化钠溶液除去铝表面的氧化膜:Al2O3+2OH-═2AlO2-+H2O | |
| D. | 在氯化亚铁溶液中通入氯气:2Fe2++Cl2═2Fe3++2Cl- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com