
| ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 | |
| 2 | C | O | F | |||||
| 3 | Na | Mg | P | S | Cl |
 .
. 分析 (1)同周期从左向右非金属性增强,同主族从上到下非金属性减弱;第3周期第ⅣA族的元素为Si;
(2)CO2的结构式为O=C=O;
(3)A.金属性越强,对应碱的碱性越强;
B.非金属性越强,对应氢化物越稳定;
C.非金属性越强,对应最高价含氧酸的酸性越强;
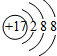
(4)氯离子(Cl-)的质子数为17,核外电子为18.
解答 解:(1)同周期从左向右非金属性增强,同主族从上到下非金属性减弱,则F的非金属性最强;第3周期第ⅣA族的元素为Si,
故答案为:F;Si;
(2)CO2的结构式为O=C=O,只存在C、O之间的共价键,故答案为:共价键;
(3)A.金属性Na>Mg,对应碱的碱性为Mg(OH)2<NaOH,故A错误;
B.非金属性F>Cl,对应氢化物稳定性:HF>HCl,故B正确;
C.非金属性S>P,对应最高价含氧酸的酸性为H3PO4<H2SO4,故C错误;
故答案为:B;
(4)氯离子(Cl-)的质子数为17,核外电子为18,离子结构示意图为 ,故答案为:
,故答案为: .
.
点评 本题考查位置、结构与性质,为高频考点,把握元素的位置、元素周期律为解答的关键,侧重分析与应用能力的考查,注意规律性知识的应用,题目难度不大.


科目:高中化学 来源:2017届江苏省高三上第一次测试化学试卷(解析版) 题型:推断题
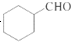
非诺洛芬是一种治疗类风湿性关节炎的药物,可通过以下方法合成:
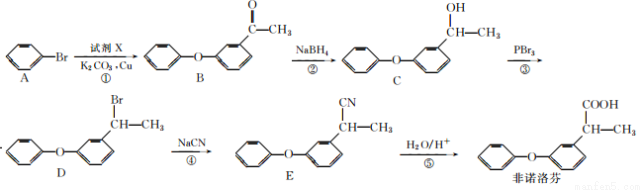
请回答下列问题:
(1)非诺洛芬中的含氧官能团为______________(填名称)。
(2)反应①中加入的试剂X的分子式为C8H8O2,X的结构简式为______________。
(3)在上述五步反应中,属于取代反应的是________(填序号)。
(4)B的一种同分异构体满足下列条件:
Ⅰ.能发生银镜反应,其水解产物之一能与FeCl3溶液发生显色反应。
Ⅱ.分子中有6种不同化学环境的氢,且分子中含有两个苯环。
写出该同分异构体的结构简式:______________。
(5)根据已有知识并结合相关信息,写出以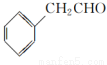 为原料制备
为原料制备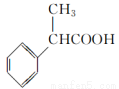 的合成路线流程图(无机试剂任用,合成路线流程图示例见本题题干)。
的合成路线流程图(无机试剂任用,合成路线流程图示例见本题题干)。
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
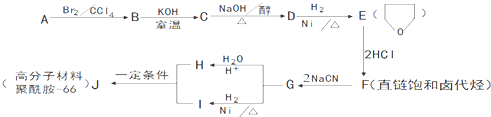
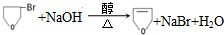 .
.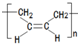 .
. .
.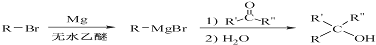
 的合成路线流程图(无机试剂任用).合成路线流程图示例如下:
的合成路线流程图(无机试剂任用).合成路线流程图示例如下:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 只有①② | B. | 只有③④ | C. | 只有②③④ | D. | ①②③④都正确 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2 mol/L的稀盐酸1L | B. | 73g HCl | ||
| C. | 44.8 L HCl | D. | 1.204×1024个HCl分子 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
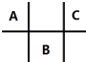 有四种短周期元素 A、B、C、D,其中 A、B、C 在周期表中所处的位置如图所示,且它们的质子数之和为 32.D 元素原子的最外层电子数为次外层电子数的2倍.则下列说法正确的是( )
有四种短周期元素 A、B、C、D,其中 A、B、C 在周期表中所处的位置如图所示,且它们的质子数之和为 32.D 元素原子的最外层电子数为次外层电子数的2倍.则下列说法正确的是( )| A. | 元素D形成的气态氢化物的空间结构一定是正四面体 | |
| B. | A、B 两种元素的气态氢化物均能不它们的最高价氧化物对应的水化物发生反应,且反应类型相同 | |
| C. | DB2、DC4中每个原子都满足8电子稳定结构 | |
| D. | 四种元素形成的气态氢化物中,C元素形成的氢化物的稳定性最高 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com