
分析 (1)氧的原子序数是8,最外层有6个电子;
(2)根据价电子对互斥理论判断杂化方式;
(3)水中氧的杂化为sp3,H3O+中氧的杂化为sp3,据此解答;
(4)硫酸铜溶于水,铜离子与水生成了呈蓝色的配合离子[Cu(H2O)4]2+.
解答 解:(1)氧的原子序数是8,核外有8个电子,最外层为2,则基态时核外电子排布式为1s22s22p4,故答案为:1s22s22p4;
(2)水分子中O原子的价层电子数=2+$\frac{1}{2}$(6-2×1)=4,且含有2对孤电子对,所以采取SP3方式杂化,故答案为:sp3;
(3)A.水中氧的杂化为sp3,H3O+中氧的杂化为sp3,则氧原子的杂化类型没有改变,故A错误;
B.水分子为V型,H3O+为三角锥型,则微粒的形状发生了改变,故B正确;
C.H3O+中氧的杂化为sp3,含有1个孤电子对,为三角锥型,故C正确;
D.水分子为V型,H3O+为三角锥型,微粒中的键角发生了改变,故D正确;
故答案为:A;
(4)将白色的无水CuSO4溶解于H2O中,溶液呈蓝色,是因为生成了一种呈蓝色的配合离子,生成此配合离子的离子方程式:Cu2++4H2O=[Cu(H2O)4]2+,
故答案为:Cu2++4H2O=[Cu(H2O)4]2+.
点评 本题考查物质结构与性质,明确电子排布、杂化轨道理论的应用、空间构型、配位键等知识即可解答,题目难度中等,侧重于基础知识的综合应用的考查.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
| A. | C2H6 | B. | C4H10 | C. | C5H8 | D. | C7H8 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
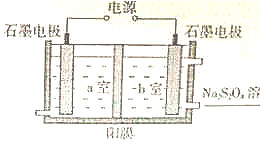
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 3,3,5-三甲基庚烷
3,3,5-三甲基庚烷 2,3-二甲基-1-丁烯
2,3-二甲基-1-丁烯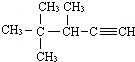 的系统名称为3,4,4-三甲基-1-戊炔.
的系统名称为3,4,4-三甲基-1-戊炔. 表示的分子式C5H12;名称是2-甲基丁烷.
表示的分子式C5H12;名称是2-甲基丁烷.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 直线形;三角锥形 | B. | V形;三角锥形 | ||
| C. | 直线形;平面三角形 | D. | V形;平面三角形 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 第I栏 | 第Ⅱ栏 | 第Ⅲ栏 |
| A | 往少量NaOH溶液中投入铝片 | 往过量NaOH溶液中投入铝片 | Al+2OH-+2H2O═2AlO2-+3H2↑ |
| B | 往Fe2(SO4)3溶液中滴入氢氧化钠溶液 | 往Fe2(SO4)3溶液中滴入氢氧化钡溶液 | Fe3++3OH-═Fe(OH)3↓ |
| C | NaHCO3溶液滴入Ca(OH)2溶液 | NaHCO3溶液滴入NaOH溶液 | OH-+HCO3-═CO32-+H2O |
| D | 往NaOH溶液中通入过量CO2气体 | 往NaOH溶液中通入少量CO2气体 | CO2+OH-═HCO3- |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
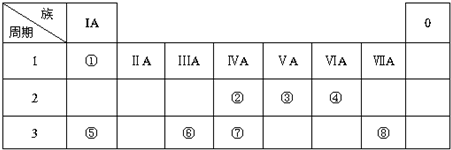
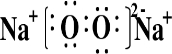 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 序号 | 操作及现象 | 结论 |
| A | 将0.1 mol•L-1氨水稀释成0.01 mol•L-1,测得 pH由11.1变成 10.6 | 稀释后NH3•H2O的电离程度减小 |
| B | 常温下,测得饱和Na2CO3溶液的pH大于 饱和NaHCO3溶液 | 常温下水解程度: CO32->HCO3- |
| C | 向25 mL冷水和沸水中分别滴入5滴FeCl3饱和溶液,前者为黄色,后者为红褐色 | 温度升高,Fe3+的水解程度增大 |
| D | 溴乙烷与NaOH乙醇溶液共热产生的气体 通入KMnO4酸性溶液中,溶液褪色 | 产生的气体为乙烯 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 某有机物燃烧只生成CO2和H2O,且二者物质的量相等,则此有机物的组成为CnH2n | |
| B. | 一种烃在足量的氧气中燃烧并通过碱石灰减少的体积就是生成水蒸气的体积 | |
| C. | 某气态烃CxHy与足量O2恰好完全反应,如果反应前后气体体积改变(温度25℃),若体积减少,则y>4,否则y<4 | |
| D. | 相同质量的烃,完全燃烧,消耗O2越多,烃中含H%越高 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com