
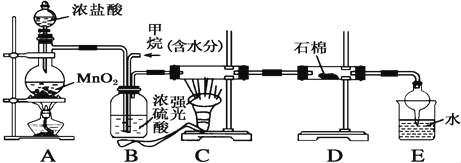
”¾ĢāÄæ”æij»ÆѧŠĖȤŠ”×éÄāŌŚŹµŃéŹŅÖŠÄ£Äā¼×ĶéÓėĀČĘų·¢ÉśČ”“ś·“Ó¦ÖĘČ”ø±²śĘ·ŃĪĖį£¬ĘäÉč¼ĘµÄÄ£Äā×°ÖĆČēĻĀ£ŗ
£Ø1£©ÉčV£ØCl2£©/V£ØCH4£©=x£¬ČōĄķĀŪÉĻÓū»ńµĆ×ī¶ąµÄĀČ»ÆĒā£¬ŌņxµÄȔֵ·¶Ī§ŹĒ £®
£Ø2£©B×°ÖĆÓŠČżÖÖ¹¦ÄÜ£ŗ
¢ŁĶعż¹Ū²ģĘųÅŻæŲÖĘĘųĢåĮ÷ĖŁ£»¢Ś £»¢Ū £®
£Ø3£©D×°ÖƵďÆĆŽÖŠ¾łŌČø½×ÅKI·ŪÄ©£¬Ęä×÷ÓĆŹĒ £®
£Ø4£©E×°ÖƵÄ×÷ÓĆŹĒ £¬ĒņŠĪĀ©¶·×÷ÓĆŹĒ £®
£Ø5£©Ņ»¶ĪŹ±¼äŗó£¬E×°ÖĆÄŚ³öĻÖµÄĻÖĻóŹĒ £®øĆ×°ÖĆ»¹ÓŠČ±ĻŻ£¬ŌŅņŹĒƻӊ½ųŠŠĪ²Ęų“¦Ąķ£¬ĘäĪ²ĘųµÄÖ÷ŅŖ³É·ÖæÉÄÜŹĒ £ØĢī±ąŗÅ£©£®
A£®CH4 B£®CH3Cl C£® CHCl3 D£®CCl4£®
”¾“š°ø”æ£Ø1£©x”Ż4£»
£Ø2£©¢ŁĶعż¹Ū²ģĘųÅŻæŲÖĘĘųĢåĮ÷ĖŁ£»¢ŚŹ¹ĘųĢå¾łŌČ»ģŗĻ£»¢ŪøÉŌļ»ģŗĻĘųĢ壻
£Ø3£©ĪüŹÕ¹żĮæµÄĀČĘų£»
£Ø4£©ĪüŹÕĀČ»ÆĒā£»·ĄÖ¹µ¹Īü£»
£Ø5£©ŅŗĢå·Ö²ć£¬ÉĻĻĀĮ½²ć¾łĪŖĪŽÉ«ŅŗĢ壻 AB£®
”¾½āĪö”æ
ŹŌĢā·ÖĪö£ŗA×°ÖĆ£ŗŹµŃéŹŅÓĆÅØŃĪĖįŗĶ¶žŃõ»ÆĆĢŌŚ¼ÓČČĢõ¼žĻĀ·¢Éś·“Ӧɜ³ÉCl2£¬B×°ÖĆ£ŗøÉŌļCl2£¬×°ÖĆC£ŗ¾øÉŌļŗóŗĶ¼×ĶéŌŚ¹āÕÕĢõ¼žĻĀ·¢ÉśČ”“ś·“Ó¦£¬Éś³É¶ąÖÖĀČ“śĢžŗĶHCl£¬ŌŚĒæ¹āÕÕÉäĻĀæÉ·¢ÉśCH4+2Cl2![]() C+4HCl£¬Éś³ÉµÄŗŚÉ«Š”æÅĮ£ĪŖĢæŗŚ£¬D×°ÖĆ£ŗĪüŹÕ¹żĮæµÄĀČĘų£¬E×°ÖĆ£ŗ×īŗóÉś³ÉµÄHClČÜÓŚĖ®Éś³ÉŃĪĖį£¬ĒņŠĪĀ©¶·ĒņŠĪ²æ·Ö¾ßÓŠ½Ļ“óæռ䣬ÄÜ·ĄÖ¹µ¹Īü£¬ÓėÓŠ»śĪļæÉÓĆ·ÖŅŗµÄ·½·Ø·ÖĄė£®
C+4HCl£¬Éś³ÉµÄŗŚÉ«Š”æÅĮ£ĪŖĢæŗŚ£¬D×°ÖĆ£ŗĪüŹÕ¹żĮæµÄĀČĘų£¬E×°ÖĆ£ŗ×īŗóÉś³ÉµÄHClČÜÓŚĖ®Éś³ÉŃĪĖį£¬ĒņŠĪĀ©¶·ĒņŠĪ²æ·Ö¾ßÓŠ½Ļ“óæռ䣬ÄÜ·ĄÖ¹µ¹Īü£¬ÓėÓŠ»śĪļæÉÓĆ·ÖŅŗµÄ·½·Ø·ÖĄė£®
£Ø1£©¼×ĶéÓėĀČĘų·¢ÉśČ”“ś·“Ӧɜ³É²śĪļĪŖĀČ»ÆĒāŗĶŅ»ĀČ¼×Ķ锢¶žĀČ¼×Ķé”¢ČżĀČ¼×ĶéŗĶĖÄĀČ»ÆĢ¼£¬ČōĄķĀŪÉĻÓū»ńµĆ×ī¶ąµÄĀČ»ÆĒā£¬ŌņÓ¦ČĆ¼×ĶéÖŠĖłÓŠµÄĒāŌ×Ó¶¼±»Č”“ś£»
£Ø2£©B×°ÖĆÓŠČżÖÖ¹¦ÄÜ£ŗ¢ŁøÉŌļĘųĢ壻¢Ś½«ĘųĢå»ģŗĻ¾łŌČ¢ŪøÉŌļ»ģŗĻĘųĢ壻
£Ø3£©µā»Æ¼ŲÄܹ»ÓėĀČĘų·“Ӧɜ³ÉĀČ»Æ¼ŲŗĶµā£¬Äܹ»ĪüŹÕ¹żĮæµÄĀČĘų£»
£Ø4£©Ī²ĘųÖŠŗ¬ÓŠĀČ»ÆĒā£¬ĀČ»ÆĒāŅ×ČÜÓŚĖ®£¬æÉŅŌÓĆĖ®ĪüŹÕĪ²Ęų£¬×¢Ņā·ĄÖ¹µ¹ĪüµÄ·¢Éś£»
£Ø5£©¼×ĶéÓėĀČĘų·¢Éś·“Ӧɜ³ÉŅ»ĀČ¼×Ķ锢¶žĀČ¼×Ķé”¢ČżĀČ¼×ĶéŗĶĖÄĀČ»ÆĢ¼£¬³żČ„Ņ»ĀČ¼×ĶéĪŖĘųĢåĶā£¬¶žĀČ¼×Ķé”¢ČżĀČ¼×ĶéŗĶĖÄĀČ»ÆĢ¼¶¼ŹĒÓĶדŅŗĢ壬²»ČÜÓŚĖ®£¬ČÜŅŗ·Ö²ć£¬æÉŅŌŃ”Ōń·ÖŅŗ·Ø·ÖĄė£¬¾Ż“Ė½ā“š£®
½ā£ŗ£Ø1£©ĀČĘųÓė¼×Ķé·¢ÉśČ”“ś·“Ó¦£¬Ņ»ĀČČ”“ś£ŗCH4+Cl2![]() CH3Cl+HCl£¬·“Ó¦ĢŲµćŹĒ1molĀČĘųæÉČ”“ś1molHŌ×ÓÉś³É1molHCl£¬ČōĄķĀŪÉĻÓū»ńµĆ×ī¶ąµÄĀČ»ÆĒā£¬Éč
CH3Cl+HCl£¬·“Ó¦ĢŲµćŹĒ1molĀČĘųæÉČ”“ś1molHŌ×ÓÉś³É1molHCl£¬ČōĄķĀŪÉĻÓū»ńµĆ×ī¶ąµÄĀČ»ÆĒā£¬Éč![]() =x£¬ŌņxÖµÓ¦±£Ö¤¼×Ķé±»ĶźČ«Č”“ś£¬x”Ż4£¬
=x£¬ŌņxÖµÓ¦±£Ö¤¼×Ķé±»ĶźČ«Č”“ś£¬x”Ż4£¬
¹Ź“š°øĪŖ£ŗx”Ż4£»
£Ø2£©B×°ÖĆÓŠČżÖÖ¹¦ÄÜ£ŗ¢ŁŹ¹ĘųĢå¾łŌČ»ģŗĻ£»¢ŚĶعż¹Ū²ģĘųÅŻæŲÖĘĘųĢåĮ÷ĖŁ¢ŪøÉŌļ»ģŗĻĘųĢ壻
¹Ź“š°øĪŖ£ŗ¢ŁĶعż¹Ū²ģĘųÅŻæŲÖĘĘųĢåĮ÷ĖŁ£»¢ŚŹ¹ĘųĢå¾łŌČ»ģŗĻ£»¢ŪøÉŌļ»ģŗĻĘųĢ壻
£Ø3£©ĀČĘų¾ßÓŠŃõ»ÆŠŌ£¬KIÖŠ©1¼ŪµÄµāÄܱ»ĀČĘųŃõ»Æ£¬²śĪļĪŖĀČ»Æ¼Ų¹ĢĢåŗĶµāµ„ÖŹ£¬ĖłŅŌ£¬D×°ÖƵďÆĆŽÖŠ¾łŌČ»ģÓŠKI·ŪÄ©£¬ÄÜĪüŹÕ¹żĮæµÄĀČĘų£¬
¹Ź“š°øĪŖ£ŗĪüŹÕ¹żĮæµÄĀČĘų£»
£Ø4£©Ī²ĘųÖŠŗ¬ÓŠĀČ»ÆĒā£¬E×°ÖĆÖŠŹ¢ÓŠĖ®£¬Äܹ»ĪüŹÕĀČ»ÆĒā·ĄÖ¹æÕĘųĪŪČ¾£¬ĀČ»ÆĒāŅ×ČÜÓŚĖ®£¬µ¼¹ÜÖ±½Ó²åČėĖ®ÖŠČŻŅ×·¢Éśµ¹Īü£¬ĒņŠĪĀ©¶·ĒņŠĪ²æ·Ö¾ßÓŠ½Ļ“óæռ䣬ÄÜ·ĄÖ¹µ¹Īü£»
¹Ź“š°øĪŖ£ŗĪüŹÕĀČ»ÆĒā£»·ĄÖ¹µ¹Īü£»
£Ø5£©¼×ĶéÓėĀČĘų·¢Éś·“Ӧɜ³ÉŅ»ĀČ¼×Ķ锢¶žĀČ¼×Ķé”¢ČżĀČ¼×ĶéŗĶĖÄĀČ»ÆĢ¼£¬³żČ„Ņ»ĀČ¼×ĶéĪŖĘųĢåĶā£¬¶žĀČ¼×Ķé”¢ČżĀČ¼×ĶéŗĶĖÄĀČ»ÆĢ¼¶¼ŹĒÓĶדŅŗĢ壬²»ČÜÓŚĖ®£¬ĻÖĻóĪŖ£ŗČÜŅŗ·Ö²ć£¬ÉĻĻĀĮ½²ć¾łĪŖĪŽÉ«ŅŗĢ壬æÉŅŌŃ”Ōń·ÖŅŗ·Ø·ÖĄė£¬Ī²ĘųÖŠŗ¬ÓŠĪ“·“Ó¦µÄ¼×ĶéÓėÉś³ÉµÄŅ»ĀČ¼×Ķ飬¹ŹŃ”AB£»
¹Ź“š°øĪŖ£ŗŅŗĢå·Ö²ć£¬ÉĻĻĀĮ½²ć¾łĪŖĪŽÉ«ŅŗĢ壻 AB£®



| Äź¼¶ | øßÖŠæĪ³Ģ | Äź¼¶ | ³õÖŠæĪ³Ģ |
| øßŅ» | øßŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” | ³õŅ» | ³õŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” |
| ø߶ž | ø߶žĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õ¶ž | ³õ¶žĆā·ŃæĪ³ĢĶĘ¼ö£” |
| øßČż | øßČżĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õČż | ³õČżĆā·ŃæĪ³ĢĶĘ¼ö£” |
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”潫Ņ»¶ØÖŹĮæµÄĆ¾”¢ĶŗĻ½š¼ÓČėµ½Ļ”ĻõĖįÖŠ£¬Į½ÕßĒ”ŗĆĶźČ«·“Ó¦£¬¼ŁÉč·“Ó¦¹ż³ĢÖŠ»¹Ō²śĪļČ«ŹĒNO£¬ĻņĖłµĆČÜŅŗÖŠ¼ÓČėĪļÖŹµÄĮæÅضČĪŖ3mol/LNaOHČÜŅŗÖĮ³ĮµķĶźČ«£¬²āµĆÉś³É³ĮµķµÄÖŹĮæ±ČŌŗĻ½šµÄÖŹĮæŌö¼Ó5.1g£¬ŌņĻĀĮŠÓŠ¹ŲŠšŹöÖŠ²»ÕżČ·µÄŹĒ£Ø £©
A£®ČܽāŗĻ½šŹ±ŹÕ¼Æµ½NOĘųĢåĢå»żĪŖ2.24L£ØŌŚ±ź×¼×“æö£©
B£®¼ÓČėŗĻ½šµÄÖŹĮæ²»æÉÄÜĪŖ9.6g
C£®³ĮµķĶźČ«Ź±ĻūŗÄNaOHČÜŅŗµÄĢå»żĪŖ150mL
D£®²Ī¼Ó·“Ó¦µÄĻõĖįµÄĪļÖŹµÄĮæĪŖ0.4mol
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æ±½·ÓµÄ»ÆѧŹ½ŹĒC6H6O£¬ŹĒŅ»ÖÖÓŠ¶¾µÄĪļÖŹ£¬¶Ōʤ·ō”¢š¤Ä¤ÓŠĒæĮŅµÄøÆŹ“×÷ÓĆ£®2014Äź6ŌĀ£¬Ņ»Į¾ŌŲÓŠ½ü30¶Ö±½·ÓµÄ²Ū¹Ž³µ²ą·£¬Ō¼ÓŠ10¶ÖµÄ±½·ÓŠ¹Ā©£¬Ōģ³ÉŗÜ“ó³Ģ¶ČµÄĪŪČ¾£®
£Ø1£©ÄćČĻĪŖĻĀĮŠ¶ŌŹĀ¹ŹµÄ“¦Ąķ·½·ØŗĻĄķµÄŹĒ £®
A”¢ÓĆ¼īŠŌČÜŅŗ³åĻ“æÉŅŌ¼õÉŁ±½·ÓµÄ»Ó·¢
B”¢ĶŚøōĄė¹µ”¢ĘĢĤ·ĄÖ¹Ą©É¢²¢»ŲŹÕŠ¹Ā©µÄ±½·Ó
C”¢Ėꏱ¼ą²āø½½üĖ®Ō“”¢ĶĮČĄÖŠµÄ±½·ÓµÄŗ¬Įæ
D”¢ÓĆĖ®Čܽāŗó»ŲŹÕ
£Ø2£©ÓĆľŠ¼Īüø½²ŠÓąµÄ±½·Ó£¬Č»ŗóµć»šČ¼ÉÕ³żČ„£®Š“³ö±½·ÓŌŚæÕĘųÖŠĶźČ«Č¼ÉյĻÆѧ·½³ĢŹ½£ŗ £®
£Ø3£©ČēĶ¼ŹĒ“Ó±½·ÓµÄŅŅ“¼ČÜŅŗÖŠ·ÖĄė»ŲŹÕ±½·ÓµÄ²Ł×÷Į÷³ĢĶ¼£ŗ

øł¾ŻĶ¼Ź¾Ķź³ÉĻĀĮŠĪŹĢā£ŗ
¢ŁŹŌ¼ĮAµÄ»ÆѧŹ½ĪŖ £®
¢Ś²½Öč¢ŪµÄ²Ł×÷Ćū³ĘĪŖ £®
¢ŪŠ“³öC+D©”śE+C6H5OHµÄ»Æѧ·½³ĢŹ½£ŗ £®
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æCŹĒŅ»ÖÖŗĻ³ÉŹ÷Ö¬£¬ÓĆÓŚÖʱøĖÜĮĻŗĶŗĻ³ÉĻĖĪ¬£¬DŹĒŅ»ÖÖÖ²ĪļÉś³¤µ÷½Ś¼Į£¬ÓĆĖüæÉŅŌ“ߏģ¹ūŹµ£®øł¾ŻŅŌĻĀ»Æѧ·“Ó¦æņĶ¼ĢīæÕ£ŗ
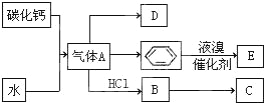
£Ø1£©Š“³öAµÄµē×ÓŹ½ £»DµÄ×ī¼ņŹ½ĪŖ £®
£Ø2£©Š“³öĢ¼»ÆøĘÓėĖ®·“Ó¦ÖĘČ”AµÄ»Æѧ·½³ĢŹ½ £®
£Ø3£©±½ŗĶŅŗäå·“Ó¦Éś³ÉEµÄ»Æѧ·½³ĢŹ½ £¬Ęä·“Ó¦ĄąŠĶĪŖ £®
£Ø4£©D»¹æÉŅŌÓĆŹÆĄÆÓĶÖĘČ”£¬¹¤ŅµÉĻÓÉŹÆÓĶ»ńµĆĘūÓĶ”¢ĆŗÓĶ”¢ŹÆĄÆÓĶµČ³É·ŻµÄ·½·ØŹĒ £®
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æĻĀĆęŹĒŹÆĄÆÓĶŌŚ³ćČČĖé“ÉʬµÄ×÷ÓĆĻĀ²śÉśC2H4²¢¼ģŃéC2H4ŠŌÖŹµÄŹµŃ飬Ķź³ÉĻĀĮŠø÷Š”Ģā£®
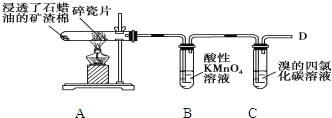
£Ø1£©Ėé“ÉʬµÄ×÷ÓĆŹĒ £®
£Ø2£©BÖŠĻÖĻóŹĒ £¬ŅŅĻ©·¢Éś ·“Ó¦£®
£Ø3£©CÖŠĻÖĻóŹĒ £¬·¢Éś·“Ó¦µÄ»Æѧ·½³ĢŹ½ £®
£Ø4£©ŌŚD“¦µćČ¼Ź±±ŲŠė½ųŠŠµÄ²Ł×÷ŹĒ £®
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æĻĀĮŠĖµ·ØÕżČ·µÄŹĒ
A£®Ąė×Ó»ÆŗĻĪļµÄČŪµćŅ»¶Ø±Č¹²¼Ū»ÆŗĻĪļČŪµćøß
B£®¼×ĶéµÄ±ź×¼Č¼ÉÕČČĪŖ890.3KJ/mol£¬Ōņ¼×ĶéČ¼ÉÕµÄČČ»Æѧ·½³ĢŹ½æɱķŹ¾ĪŖ£ŗCH4(g)+2O2(g)=CO2(g)+2H2O(g) ”÷H=-890.3kJ”¤mol-1
C£®500”ę”¢30MPaĻĀ£¬½«0.5mol N2ŗĶ1.5molH2ÖĆÓŚĆܱյÄČŻĘ÷ÖŠ³ä·Ö·“Ӧɜ³ÉNH3(g)£¬·ÅČČ19.3kJ£¬ĘäČČ»Æѧ·½³ĢŹ½ĪŖN2(g)+3H2(g) ![]() 2NH3(g) ”÷H=£38.6kJ”¤mol-1
2NH3(g) ”÷H=£38.6kJ”¤mol-1
D£®Ķ¬ĪĀĶ¬Ń¹ĻĀ£¬H2(g)+Cl2(g)=2HCl(g)ŌŚ¹āÕÕĢõ¼žŗĶµćČ¼Ģõ¼žĻĀµÄ”÷HĻąĶ¬
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æ
¢Ł ¹żĀĖ ¢Ś Õō·¢ ¢Ū Čܽā ¢Ü ĻņČŻĮæĘæ×ŖŅĘŅŗĢå
A. ¢ŁŗĶ¢Ś B. ¢ŁŗĶ¢Ū C. ¢ŪŗĶ¢Ü D. ¢ŁŗĶ¢Ü
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æ(1)ÖŹĮæÖ®±ČĪŖ16:7:6µÄČżÖÖĘųĢåSO2”¢CO”¢NO£¬·Ö×ÓøöŹżÖ®±ČĪŖ________£»ŃõŌ×ÓøöŹżÖ®±ČĪŖ________£»ĻąĶ¬Ģõ¼žĻĀµÄĢå»żÖ®±ČĪŖ________”£
(2)±ź×¼×“æöĻĀ£¬1.7 g NH3µÄĢå»żĪŖ________L£¬ĖüÓė±ź×¼×“æöĻĀ________L H2Sŗ¬ÓŠĻąĶ¬ŹżÄæµÄĒāŌ×Ó”£
(3)ijĘųĢåŃõ»ÆĪļµÄ»ÆѧŹ½ĪŖRO2£¬ŌŚ±ź×¼×“æöĻĀ£¬1.28 gøĆŃõ»ÆĪļµÄĢå»żĪŖ448 mL£¬ŌņøĆŃõ»ÆĪļµÄĦ¶ūÖŹĮæĪŖ______£¬RµÄĻą¶ŌŌ×ÓÖŹĮæĪŖ________”£
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æŌŚČŻ»ż²»±äµÄĆܱÕČŻĘ÷ÖŠ“ęŌŚČēĻĀ·“Ó¦£ŗ2SO2£Øg£©£«O2£Øg£©![]() 2SO3£Øg£©””¦¤H£¼0”£Ä³ŃŠ¾æŠ”×éŃŠ¾æĮĖĘäĖūĢõ¼ž²»±äŹ±£¬øıäijŅ»Ģõ¼ž¶ŌÉĻŹö·“Ó¦µÄÓ°Ļģ£¬ĻĀĮŠ·ÖĪöÕżČ·µÄŹĒ£Ø””””£©
2SO3£Øg£©””¦¤H£¼0”£Ä³ŃŠ¾æŠ”×éŃŠ¾æĮĖĘäĖūĢõ¼ž²»±äŹ±£¬øıäijŅ»Ģõ¼ž¶ŌÉĻŹö·“Ó¦µÄÓ°Ļģ£¬ĻĀĮŠ·ÖĪöÕżČ·µÄŹĒ£Ø””””£©

A. Ķ¼¢ń±ķŹ¾µÄŹĒtŹ±æĢŌö“óO2µÄÅØ¶Č¶Ō·“Ó¦ĖŁĀŹµÄÓ°Ļģ
B. Ķ¼¢ņ±ķŹ¾µÄŹĒtŹ±æĢ¼ÓČė“߻ƼĮ¶Ō·“Ó¦ĖŁĀŹµÄÓ°Ļģ
C. Ķ¼¢ó±ķŹ¾µÄŹĒ“߻ƼĮ¶ŌĘ½ŗāµÄÓ°Ļģ£¬ĒŅ¼×µÄ“߻ƼĮŠ§ĀŹ±ČŅŅøß
D. Ķ¼¢ó±ķŹ¾µÄŹĒŃ¹Ēæ¶Ō»ÆŃ§Ę½ŗāµÄÓ°Ļģ£¬ĒŅŅŅµÄŃ¹Ēæ½Ļøß
²éæ““š°øŗĶ½āĪö>>
°Ł¶ČÖĀŠÅ - Į·Ļ°²įĮŠ±ķ - ŹŌĢāĮŠ±ķ
ŗž±±Ź”»„ĮŖĶųĪ„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±ØĘ½ĢØ | ĶųÉĻÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | µēŠÅÕ©Ę¾Ł±Ø×ØĒų | É꥜Ź·ŠéĪŽÖ÷ŅåÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | ÉęĘóĒÖČؾŁ±Ø×ØĒų
Ī„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±Øµē»°£ŗ027-86699610 ¾Ł±ØÓŹĻä£ŗ58377363@163.com