
| A. | 称取Cu(NO3)•3H2O于烧杯中,加入适量蒸馏水使其溶解得蓝色澄清溶液 | |
| B. | 把Na2CO3白色粉末加入Cu(NO3)•3H2O溶液中,同时加热促进反应 | |
| C. | 搅拌反应体系一段时间后析出大量绿色沉淀 | |
| D. | 将反应混合物过滤得绿色固体产品,用蒸馏水洗三次,烘干既得产品 |
分析 Cu(NO3)•3H2O水解显酸性,Na2CO3水解显碱性,氢离子和氢氧根反应生成水,相互促进,可制备碱式碳酸铜2CuCO3•Cu(OH)2,据此解题.
A.Cu(NO3)•3H2O易溶于水;
B.碱式碳酸铜加热易分解;
C.碱式碳酸铜不溶于水;
D.洗涤烘干可得产品.
解答 解:A.Cu(NO3)•3H2O易溶于水,可得蓝色澄清溶液,故A正确;
B.碱式碳酸铜加热易分解,不能加热,故B错误;
C.碱式碳酸铜不溶于水,为绿色沉淀,故C正确;
D.过滤得到碱式碳酸铜,洗涤烘干可得产品,故D正确.
故选B.
点评 本题考查物质的制备,为高考常见题型和高频考点,侧重于学生的分析能力、实验能力的考查,注意把握题给信息,结合物质的性质设计实验步骤,题目难度不大.


科目:高中化学 来源: 题型:解答题
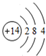 .
. ;V的氢氧化物作弱酸时有类似TR4-的离子产生,其电离方程式为Al(OH)3+H2O?H++[Al(OH)4]-.
;V的氢氧化物作弱酸时有类似TR4-的离子产生,其电离方程式为Al(OH)3+H2O?H++[Al(OH)4]-.查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 取代、加成、取代 | B. | 还原、消去、加成 | C. | 氧化、加成、消去 | D. | 氧化、取代、取代 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 20gD2O所含电子数为10NA | |
| B. | 25℃时,pH=13的Ba(OH)2溶液中含有的OH-数目为0.1NA | |
| C. | 1molNa被氧化成Na2O2,失去电子数目为2NA | |
| D. | 氢气与氯气反应生成标准状况下22.4L氯化氢,断裂化学键总数为2NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 碳酸钠、氢氧化钠、氯化钡 | B. | 氯化钡、氢氧化钠、碳酸钠 | ||
| C. | 氢氧化钠、碳酸钠、氯化钡 | D. | 碳酸钠、氯化钡、氢氧化钠 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 处于第5周期 | |
| B. | 质子数与中子数之差为50 | |
| C. | 原子的核外电子数是39 | |
| D. | ${\;}_{39}^{89}$Y和${\;}_{39}^{90}$Y是两种不同的核素 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
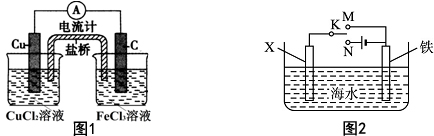
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
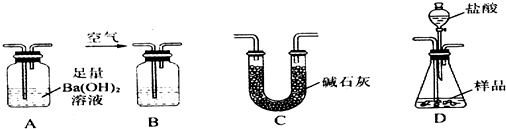
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com