
溶液的体积:溶解或稀释时烧杯中有水,以及定容前容量瓶中有水,溶质的物质的量浓度
________(填“偏大”、“偏小”或“不受影响”).定容时要平视刻度线,使凹液面的最低处与视线在同一水平线上,不能仰视或俯视刻度线.定容时不小心加水超过刻度线,要重新配制溶液. 名校联盟快乐课堂系列答案
名校联盟快乐课堂系列答案 黄冈创优卷系列答案
黄冈创优卷系列答案科目:高中化学 来源: 题型:阅读理解
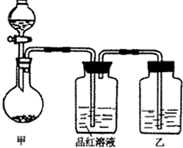 (2009?三明一模)张明同学在学习“硫酸及其盐的某些性质与用途“中,进行如下实验探究.
(2009?三明一模)张明同学在学习“硫酸及其盐的某些性质与用途“中,进行如下实验探究.
| ||
| ||
| ||
| ||
| 实验操作 | 预期现象和结论 |
往一支试管中加入少量固体,加水溶解,再滴加几滴KSCN溶液 往一支试管中加入少量固体,加水溶解,再滴加几滴KSCN溶液 |
若溶液变为红色,说明该固体已变质;若溶液未变红色,说明该固体没有变质 若溶液变为红色,说明该固体已变质;若溶液未变红色,说明该固体没有变质 |
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
 (2011?巢湖二模)滴定法是化学定量分析的一种重要而普遍的方法.
(2011?巢湖二模)滴定法是化学定量分析的一种重要而普遍的方法.| 实验 | 样品体积/mL | 高锰酸钾溶液体积/mL |
| 1 | 10.00 | 8.98 |
| 2 | 10.00 | 8.58 |
| 3 | 10.00 | 9.02 |
| 4 | 10.00 | 9.00 |
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
| 实验 编号 |
实验步骤 | 实验现象 |
| ① | 用适量的蒸馏水溶解食盐,并将所得溶液分成2份 | |
| ② | 向第一份溶液中加入KSCN溶液,再加入氯水 | 溶液加入KSCN后无明显变化,加入氯水后变红 |
| ③ | 向第二份溶液中加入稀盐酸酸化,再加入足量KI固体,最后加入淀粉溶液 | 溶液变蓝 |
| 实验编号 | 1 | 2 | 3 |
| Na2S2O3溶液的体积/mL | 14.98 | 15.00 | 15.02 |
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
| 实验操作 | 预期现象和结论 |
| 步骤1:取适量产物样品于洁净烧杯中,加入足量蒸馏水,充分搅拌,静置,取上层清液备用. | 有不溶的黑色固体. |
| 步骤2:取适量步骤1清液于试管中, |
|
| 步骤3: |
| 滴定 次数 |
待测溶液 的体积/mL |
消耗标准盐酸的体积 | |
| V1/mL | V2/mL | ||
| 1 | 25.00 | 15.02 | 4.97 |
| 2 | 25.00 | 14.98 | 5.03 |
| 3 | 25.00 | 13.21 | 6.75 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、①②④⑥ | B、①③④⑤⑥ | C、③④⑥⑦ | D、③⑦⑧ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com