
(13分)在25℃时,将等物质的量的A、B混合于2L的密闭容器中,发生下列反应:3A(g)+B(g)  xC(g)+2D(g)
;△H>0,经5min后测知D的浓度为0.5mol/L,
xC(g)+2D(g)
;△H>0,经5min后测知D的浓度为0.5mol/L,
A、B的物质的量浓度之比为3:5,C的平均反应速率是0.1mol/(L·min),求:
(1)此时A的物质的量浓度是 ;
反应开始前容器中的A、B的物质的量:n(A)= n(B)=
(2)x的值为 ;5min内B的平均反应速率 ;
(3)下列措施能使正反应速率增大的是 (不定项选择)
A. 只增大A的浓度 B.增大反应的温度
C. 向容器中通入一定体积的He,增大反应的压强 D. 使用催化剂
(4)若改用3L的密闭容器,盛放与上述相同量的A、B气体,则达到平衡后,A和B的物质的量浓度的比值 3:5(填“>”“=”“<”)。
(13分)(1)0.75mol/L 3mol (2)0.05mol/(L·min) 2
(3) ABD (4)=
【解析】考查可逆反应的有关计算及外界条件对反应速率和平衡的影响。
(1)C的平均反应速率是0.1mol/(L·min),则C的浓度是0.5mol/L,所以根据变化量之比是相应的化学计量数之比可知x=2。又因为反应速率之比是相应的化学计量数之比,所以B的反应速率是0.1mol/(L·min)÷2=0.05mol/(L·min)。
(2)
3A(g)+B(g) 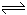 2C(g)+2D(g)
2C(g)+2D(g)
起始量(mol) n n 0 0
转化量(mol) 1.5 0.5 1.0 1.0
平衡量(mol) n-1.5 n-0.5 1.0 1.0
所以有(n-1.5)︰(n-0.5)= 3:5
解得n=3mol,所以A的浓度是1.5mol÷2L=0.75mol/L
(3)在其它条件不变的情况下,增大反应物浓度或升高温度或增大压强或使用催化剂等均能加快反应速率,选项C中浓度不变,反应速率不变,所以答案选ABD。
(4)因为反应前后体积不变,所以此时的平衡是等效的,因此比值不变。


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
 运用化学反应原理研究氮、氧等单质及其化合物的反应有重要意义.
运用化学反应原理研究氮、氧等单质及其化合物的反应有重要意义.| 10-9 |
| a-0.01 |
| 10-9 |
| a-0.01 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源:09—10年台州市高二下学期期末考试化学卷 题型:填空题
运用化学反应原理研究氮、氧等单质及其化合物的反应有重要意义。
(1)发射卫星时可用肼(N2H4)作燃料,其方程式为:N2H4+O2=N2+2H2O,若将此反应设计成如图所示的原电池装置,请回答: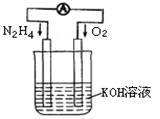
①负极反应式为: ▲ ;
②工作一段时间后正极附近溶液的pH变化为 ▲ (填“增大”“减小”或“不变”);
③若用该电池电解以石墨为电极的100mL氯化铜溶液,一段时间后,两极均收集到2.24L气体(已换算成标准状况下的体积),则原溶液中Cu2+的物质的量浓度为 ▲ 。
(2)在25℃时,向浓度均为0.1mol·L-1的MgCl2和CuCl2混合溶液中逐滴加入氨水,首先生成 ▲ 沉淀(填化学式),生成该沉淀的离子方程式为 ▲ 。(已知25℃ Ksp[Mg (OH)2]=1.8×10-11,Ksp[Cu (OH)2]=2.2×10-20)。
(3)在25℃时,将a mol·L-1的氨水与0.01mol·L-1的盐酸等体积混合,反应平衡时溶液中c(NH4+)= c(Cl-),则溶液显 ▲ 性(填“酸”“碱”或“中”),用含a的代数式表示NH3· H2O的电离常数kb= ▲ 。
查看答案和解析>>
科目:高中化学 来源:2011-2012学年河北省正定中学高二第一次考试理科化学试卷(带解析) 题型:计算题
(13分)在25℃时,将等物质的量的A、B混合于2L的密闭容器中,发生下列反应:3A(g)+B(g)  xC(g)+2D(g) ;△H>0,经5min后测知D的浓度为0.5mol/L,
xC(g)+2D(g) ;△H>0,经5min后测知D的浓度为0.5mol/L,
A、B的物质的量浓度之比为3:5,C的平均反应速率是0.1mol/(L·min),求:
(1)此时A的物质的量浓度是 ;
反应开始前容器中的A、B的物质的量:n(A)= n(B)=
(2)x的值为 ;5min内B的平均反应速率 ;
(3)下列措施能使正反应速率增大的是 (不定项选择)
A. 只增大A的浓度 B.增大反应的温度
C. 向容器中通入一定体积的He,增大反应的压强 D. 使用催化剂
(4)若改用3L的密闭容器,盛放与上述相同量的A、B气体,则达到平衡后,A和B的物质的量浓度的比值 3:5(填“>”“=”“<”)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com