
【题目】下列各组物质中,都是共价化合物的是( )
A.H2S和Na2O2
B.H2O2和CaF2
C.NH3和N2
D.HNO3和HClO3
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】利用海水提取溴和镁的过程如下,下列说法不正确的是( )
A.若提取1 mol Br2 , 至少需要标准状况下44.8 L的Cl2
B.工业上常利用电解熔融MgCl2冶炼金属镁
C.富集溴元素过程中,空气吹出法利用了溴易挥发的性质
D.工业溴中含少量Cl2 , 可用NaOH溶液除去
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以铬铁矿(主要成份为FeO·Cr2O3,还含有Al2O3、MgO等杂质)为主要原料生产二水合重铬酸钠(Na2Cr2O7·2H2O),其主要工艺流程如下图所示。

回答下列问题:
(1)二水合重铬酸钠(Na2Cr2O7·2H2O)中Cr的化合价为________________。
(2)已知:步骤①中涉及的主要反应是FeO·Cr2O3+Na2CO3+O2![]() Na2CrO4+Fe2O3+CO3(未配平),该反应中氧化剂和还原剂的物质的量比为_____________。
Na2CrO4+Fe2O3+CO3(未配平),该反应中氧化剂和还原剂的物质的量比为_____________。
(3)滤渣1的主要成分为MgO和_____(填化学式);滤渣2的成分是______(填物质名称)。
(4)步骤④,向滤液中加入稀硫酸,溶液由黄色变为橙色,得到Na2Cr2O7和Na2SO4的混合溶液,发生反应的离子方程式为_______________。
(5)经步骤④酸化后的溶液中获得Na2Cr2O7·2H2O晶体的操作依次是蒸发浓缩、____、过滤、洗涤、干燥。
(6)该工艺的酸性废液中含有Cr2O72-,可向废液中加入绿矾(FeSO4·7H2O)还原处理。若处理20m3的Cr2O72-酸性废液,需要绿矾166.8g,则原废液中Cr2O72-的物质的量浓度为_____mol/L。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据要求回答下列有关问题。
(1)高炉炼铁是冶炼铁的主要方法,发生的主要反应为:Fe2O3(s)+3CO(g) ![]() 2Fe(s)+3CO2(g) H=-28.5kJ/mol,冶炼铁反应的平衡常数表达式K= , 温度升高后,K 值(填“增大”、“不变”或“减小”)。
2Fe(s)+3CO2(g) H=-28.5kJ/mol,冶炼铁反应的平衡常数表达式K= , 温度升高后,K 值(填“增大”、“不变”或“减小”)。
(2)已知:①Fe2O3(s)+3C(石墨) = 2Fe(s)+3CO(g) H1= +489.0kJ/mol
②Fe2O3(s)+3CO(g) ![]() 2Fe(s)+3CO2(g) H2= -28.5kJ/mol
2Fe(s)+3CO2(g) H2= -28.5kJ/mol
③C(石墨)+ CO2(g) = 2CO(g) H3= akJ/mol ,
则a=kJ/mol。
(3)在T℃时,反应Fe2O3(s)+3CO(g) ![]() 2Fe(s)+3CO2(g)的平衡常数K=64,在2L恒容密闭容器中,按下表所示加入物质,经过一段时间后达到平衡。
2Fe(s)+3CO2(g)的平衡常数K=64,在2L恒容密闭容器中,按下表所示加入物质,经过一段时间后达到平衡。
Fe2O3 | CO | Fe | CO2 | |
始态mol | 1.0 | 1.0 | 1.0 | 1.0 |
①平衡时CO 的转化率为。
②下列情况标志反应达到平衡状态的是(填字母)。
a.容器内气体密度保持不变
b.容器内气体压强保持不变
c.CO的消耗速率和CO2的生成速率相等
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为测定某烃A的分子组成和结构,对这种烃进行以下实验:
![]() 取一定量的该烃,使其充分燃烧后的气体通过干燥管,干燥管增重
取一定量的该烃,使其充分燃烧后的气体通过干燥管,干燥管增重![]() ;再通过石灰水,石灰水增重
;再通过石灰水,石灰水增重![]() 。
。
![]() 经测定,该烃(气体)
经测定,该烃(气体)![]() 在标准状况下的密度为
在标准状况下的密度为![]() 。
。
现以A为主要原料合成乙酸乙酯,其合成路线如图1所示。
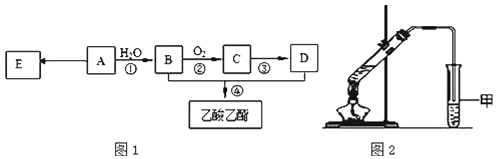
(1)![]() 该烃A能与______g溴发生加成反应;加成产物需______mol溴蒸气完全取代;
该烃A能与______g溴发生加成反应;加成产物需______mol溴蒸气完全取代;
(2)B中官能团的名称是_________,B通过两次氧化可得到D,也可通过加入的氧化试剂为______![]() 任填一种
任填一种![]() 直接氧化为D.
直接氧化为D.
(3)E是常见的高分子材料,写出E的结构简式__________;合成E的反应类型_______________;
(4)某同学用如图2所示的实验装置制取少量乙酸乙酯。实验结束后,试管甲中上层为透明的、不溶于水的油状液体。
①实验开始时,试管甲中的导管不伸入液面下的原因是__________________;
②上述实验中饱和碳酸钠溶液的作用是__________________![]() 填字母
填字母![]() ;
;
A.中和乙酸和乙醇
B.中和乙酸并吸收部分乙醇
C.降低乙酸乙酯在水中的溶解度,有利于分层析出
D.加速酯的生成,提高其产率
![]() 在实验室利用B和D制备乙酸乙酯的实验中,若用1molB和1molD充分反应,不能生成1mol乙酸乙酯,原因是______________________________.
在实验室利用B和D制备乙酸乙酯的实验中,若用1molB和1molD充分反应,不能生成1mol乙酸乙酯,原因是______________________________.
(5)与乙酸乙酯互为同分异构体且能与![]() 反应生成CO2的有机物的结构简式为:
反应生成CO2的有机物的结构简式为:
________________、_____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述正确的是( )
A. 任何晶体中,若含有阳离子,就一定含有阴离子
B. 金属晶体的形成是因为晶体中存在金属离子间的相互作用
C. 价电子越多的金属原子的金属性越强
D. 含有金属元素的离子不一定是阳离子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】室温下,将1.000mol·L-1盐酸滴入20.00mL 1.000mol·L-1氨水中,溶液pH和温度随加入盐酸体积变化曲线如下图所示。下列有关说法正确的是( )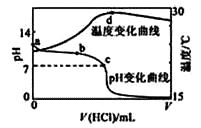
A.a点由水电离出的c(H+)=1.0×10-14mol/L
B.b点:c(NH4+)+c(NH3·H2O) > c(Cl-)
C.c点:反应消耗的HCl 和NH3·H2O 的关系为:n(HCl)= n(NH3·H2O)
D.d点后,溶液温度略下降的主要原因是NH3·H2O电离吸热
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法中正确的是( )
A.2gH2所占有的体积是22.4L
B.常温下压下32gO2与标准状况下22.4LN2含有相同的分子数
C.标准状况下,22.4LH2O含有6.02×1023个H2O分子
D.11.2LO2的质量是16g
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在周期表中有一种现象,上下相邻的两种元素原子序数一个为AB,另一个为BA(A,B为0到9的整数且B>A),则周期表中这样的元素一共有几对( )
A.3
B.4
C.5
D.6
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com