
| A. | 乙醛和水 | B. | 苯和硝基苯 | C. | 乙酸乙酯和水 | D. | 溴乙烷和氯仿 |
科目:高中化学 来源: 题型:选择题
| A. | 金属钠着火时使用泡沫灭火器灭火 | |
| B. | 制备乙烯时向乙醇和浓硫酸的混合液中加入碎瓷片 | |
| C. | 浓硫酸溅到皮肤上时立即用稀氢氧化钠溶液冲洗 | |
| D. | 用试管加热碳酸氢钠固体时使试管口竖直向上 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 若在恒温恒压下:当x=1时,按1.5molA、1molC作为起始物质,达到平衡后,C的体积分数仍为a | |
| B. | 若在恒温恒容下:当x=2时,将3molC作为起始物质,达到平衡后,C的体积分数仍为a | |
| C. | 若在恒温恒压下:当x=3时,按1molA、1molB、1molC作为起始物质,达到平衡后,C的体积分数为a | |
| D. | 若在恒温恒容下:按0.6molA、0.3molB、1.4molC作为起始物质,达到平衡后,C的体积分数仍为a,则x为2或3 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 ,W与R以1:3的原子个数比形成的化合物的电子式
,W与R以1:3的原子个数比形成的化合物的电子式 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 除去乙烷中少量的乙烯,可将混合气体通入酸性高锰酸钾溶液 | |
| B. | 除去苯中含有的少量苯酚,可加入浓溴水过滤,即可除去苯酚 | |
| C. | 乙酸乙酯中混有乙酸,可用饱和Na2CO3溶液洗涤,然后分液分离出乙酸乙酯 | |
| D. | 在提纯鸡蛋中的蛋白质时,可向鸡蛋清溶液中加入浓CuSO4溶液,然后滤出沉淀,即得较纯的蛋白质 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 在灼烧过程中使用的仪器有酒精灯、三脚架、泥三角、蒸发皿、玻璃棒 | |
| B. | 在上述氧化过程中发生的离子方程式为:2I-+H2O2═I2+2OH- | |
| C. | 在分液时,待下层液体完全流出后,关闭旋塞,上层液体从上口倒出 | |
| D. | 在提取碘单质时,用酒精作萃取剂 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
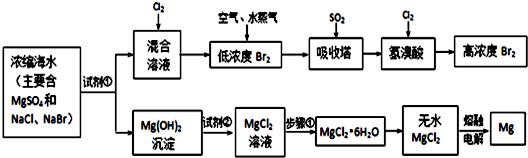
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

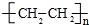 ,该反应属于加聚反应;
,该反应属于加聚反应;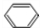 +Br2$\stackrel{FeBr_{3}}{→}$
+Br2$\stackrel{FeBr_{3}}{→}$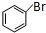 +HBr.
+HBr.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com