
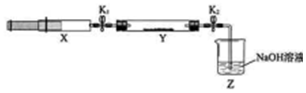
| 操作步骤 | 实验现象 | 解释原因 |
| 打开K1,推动注射器活塞,使X中的气体缓慢通入Y管中 | ①Y管中红棕色气体慢慢变浅 | ②反应的化学方程式 8NH3+6NO2 $\frac{\underline{\;催化剂\;}}{\;}$7N2+12H2O |
| 将注射器活塞退回原处并固定,待装置恢复到室温 | Y管中有少量水珠 | 生成的气态水凝集 |
| 打开K2 | ③Z中NaOH溶液产生倒吸现象 | ④反应后气体分子数减少,Y管中压强小于外压 |
分析 打开K1,推动注射器活塞,使X中的气体缓慢充入Y管中,则氨气与二氧化氮发生归中反应生成无色氮气,所以看到现象为:红棕色变浅;
依据8NH3+6NO2=7N2+12H2O以及气态水凝聚判断,反应后气体分子数减少从而判断打开K2发生的现象.
解答 解:打开K1,推动注射器活塞,使X中的气体缓慢充入Y管中,则氨气与二氧化氮发生归中反应 生成无色氮气,所以看到现象为:红棕色气体慢慢变浅;
根据反应8NH3+6NO2$\frac{\underline{\;催化剂\;}}{\;}$7N2+12H2O以及装置恢复至室温后气态水凝聚可判断,反应后气体分子数减少,装置内压强降低,所以打开K2在大气压的作用下发生倒吸;
故答案为:
| 操作步骤 | 实验现象 | 解释原因 |
| 红棕色气体慢慢变浅 | 8NH3+6NO2$\frac{\underline{\;催化剂\;}}{\;}$7N2+12H2O | |
| Z中NaOH溶液产生倒吸现象 | 反应后气体分子数减少,Y管中压强小于外压 |
点评 本题考查了氮氧化物的性质和反应现象的分析判断,明确装置的原理及制备气体的一般程序是解题关键,题目难度不大.


 53随堂测系列答案
53随堂测系列答案科目:高中化学 来源: 题型:解答题
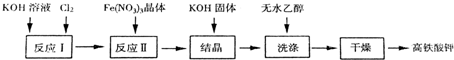
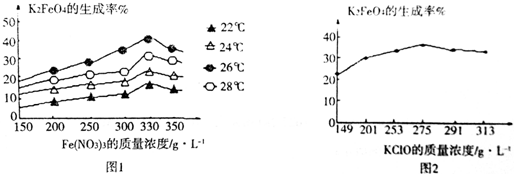
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
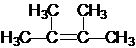 名称为2,3-二甲基-2-丁烯
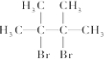
名称为2,3-二甲基-2-丁烯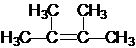 →
→
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 温度/℃ | 25 | 90℃ | 100℃ |
| 水的离子积常数 | 1×10-14 | 3.8×10-13 | 1×10-12 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 微粒组 | 所加试剂 | 离子方程式 |
| A | NH4+、Mg2+、SO42- | 少量Ba(OH)2溶液 | NH4++SO42-+Ba2++OH-=BaSO4↓+NH3•H2O |
| B | Mg2+、HCO3-、Cl- | 过量NaOH溶液 | Mg2++2HCO3-+2OH-=MgCO3-↓+CO32-+2H2O |
| C | H+、Na+、NO3- | Fe粉 | Fe+2H+=Fe2++H2↑ |
| D | Ca2+、NH3•H2O、Cl- | 通入过量CO2 | NH3•H2O+CO2=NH4++HCO3- |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
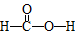 ,Ka=1.8×10-4),通常情况下是一种无色易挥发的液体.甲酸在浓硫酸作用下容易分解产生CO.某化学兴趣小组的同学对HCOOH的性质进行了以下探究:
,Ka=1.8×10-4),通常情况下是一种无色易挥发的液体.甲酸在浓硫酸作用下容易分解产生CO.某化学兴趣小组的同学对HCOOH的性质进行了以下探究: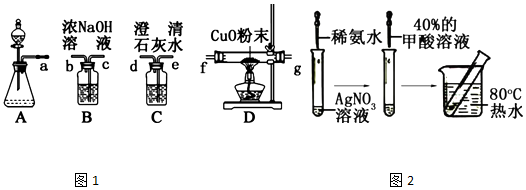
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①②③⑦ | B. | 除⑤⑥外 | C. | ②③⑦ | D. | 全部 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
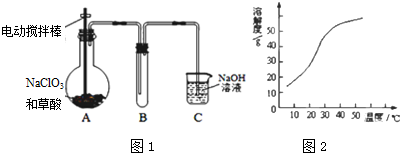
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com