
密闭容器中充有![]() 的混合气体,点燃后刚好完全反应,再冷却到室温,得到的溶液中溶质的质量分数为33.6%,则原混合气中三种气体的体积之比为
的混合气体,点燃后刚好完全反应,再冷却到室温,得到的溶液中溶质的质量分数为33.6%,则原混合气中三种气体的体积之比为
[ ]
 培优三好生系列答案
培优三好生系列答案 优化作业上海科技文献出版社系列答案
优化作业上海科技文献出版社系列答案科目:高中化学 来源: 题型:
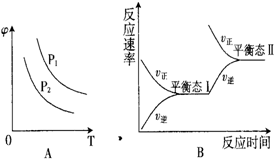 硫酸生产过程中关键阶段的反应为:
硫酸生产过程中关键阶段的反应为:| 催化剂 | 加热 |
查看答案和解析>>
科目:高中化学 来源: 题型:013
密闭容器中充有![]() 的混合气体,点燃后刚好完全反应,再冷却到室温,得到的溶液中溶质的质量分数为33.6%,则原混合气中三种气体的体积之比为
的混合气体,点燃后刚好完全反应,再冷却到室温,得到的溶液中溶质的质量分数为33.6%,则原混合气中三种气体的体积之比为
[ ]
查看答案和解析>>
科目:高中化学 来源:2013-2014学年广东省等六校高三第三次联考理综化学试卷(解析版) 题型:填空题
汽车尾气里含有的NO气体是由于内燃机燃烧的高温引起氮气和氧气反应所致:
N2(g)+O2(g)
 2NO(g)
ΔH,已知该反应在 T ℃时,平衡常数K=9.0。
2NO(g)
ΔH,已知该反应在 T ℃时,平衡常数K=9.0。
请回答:
(1)已知:N2(g)+2O2(g)  2NO2(g) ΔH1 2NO2(g)
2NO2(g) ΔH1 2NO2(g)  O2+2NO(g) ΔH2 ΔH=
(用含ΔH1、ΔH2的表达式表示);
O2+2NO(g) ΔH2 ΔH=
(用含ΔH1、ΔH2的表达式表示);
(2)某温度下,向2 L的密闭容器中充入N2和O2各1 mol,5分钟后O2的物质的量为0.5 mol,则NO的反应速率 ;
(3)假定该反应是在恒容条件下进行,下列能判断该反应已达到平衡的是________;
A.消耗1 mol N2同时生成1 mol O2
B.混合气体密度不变
C.混合气体平均相对分子质量不变
D.2v正(N2)=v逆(NO)
(4)下图是反应N2(g)+O2(g)  2NO(g)的“K-T”、“c(NO)-t”图,由图A可以推知该反应为
反应(填“吸热”或“放热”)。由图B可知,与a对应的条件相比,b改变的条件可以是 ;
2NO(g)的“K-T”、“c(NO)-t”图,由图A可以推知该反应为
反应(填“吸热”或“放热”)。由图B可知,与a对应的条件相比,b改变的条件可以是 ;
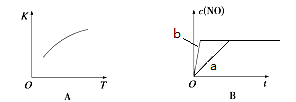
(5)T ℃时,某时刻测得容器内N2、O2、NO的浓度分别为0.20 mol·L-1、0.20mol·L-1和0.50mol·L-1,此时反应N2(g)+O2(g)
 2NO(g)________________(填“处于化学平衡状态”、“向正反应方向进行”或“向逆反应方向进行”),平衡时,N2在混合气体的体积百分数为多少?(在答题卡上写出具体计算过程,结果保留2位有效数字)
2NO(g)________________(填“处于化学平衡状态”、“向正反应方向进行”或“向逆反应方向进行”),平衡时,N2在混合气体的体积百分数为多少?(在答题卡上写出具体计算过程,结果保留2位有效数字)
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
依照阿伏加德罗定律,下列叙述正确的是
( ) A.同温同压下两种气体的体积之比等于摩尔质量之比。
B.同温同压下两种气体的物质的量之比等于密度之比。 C.同温同压下两种气体的摩尔质量之比等于密度之比。D.同温同体积下两种气体的物质的量之比等于压强之比。
设NA表示阿伏加德罗常数,下列说法不正确的是 ( )
A. 醋酸的摩尔质量与NA个醋酸分子的质量在数值上相等。
B.标准状况下,以任意比混和的氢气和一氧化碳气体共8.96L,在足量氧气中充分燃烧时消耗氧气的分子数为0.2 NA。
C.1L1mol/LCuCl2溶液中含有的Cu2+的个数为NA。
D.25℃,1.01×105Pa时,16g臭氧所含的原子数为NA。
设NA表示阿伏加德罗常数的数值,下列说法正确的是 ( )
A.用惰性电极电解500mL饱和食盐水时,若溶液的pH值变为14时,则电极上转移的电子数目为NA。
B.在标准状况下,各为1mol的二氧化硫、三氧化硫的体积均约为22.4L。
C. 在常温常压下,6g石英晶体中,含有0.4NA个硅氧共价键。
D.120g由NaHSO4和KHSO3组成的混合物中含有硫原子NA个。
标准状况下,下列混合气体的平均式量可能是50的是 ( )
A.硫化氢和二氧化硫 B.一氧化氮和氧气
C.二氧化硫和溴化氢 D.碘化氢和氯气
在一个恒容密闭容器中充入11gX气体(摩尔质量为 44g·mol-1),压强为1×105pa。如果保持温度不变,继续充入X气体,使容器内压强达到5×105pa。则此时容器内的气体X的分子数约为 ( )
A.3.3×1025 B.3.3×1024 C.7.5×1023 D.7.5×1022
由二氧化碳、氢气、一氧化碳组成的混合气体在同温、同压下与氮气的密度相同。则该混合气体中二氧化碳、氢气、一氧化碳的体积比为 ( )
A.29∶8∶13 B.22∶1∶14 C.13∶8∶29 D.26∶16∶57
同温、同压下,CO2 和NO的混合气体 20mL,通过足量过氧化钠后气体体积减少到10mL,则原混合气体的体积比可能是 ( )
A.1∶1 B.2∶3 C.3∶2 D.1∶4
乙炔和乙烯的混合气体完全燃烧时,所需氧气的体积是原混合气体的2.7倍,则该混合气体与足量的H2发生加成反应时,消耗H2的体积是原混合气体体积的 ( ) A.1.6倍 B.1.8倍 C.1.4倍 D.1.2倍
在一定条件下,将5体积NO、5体积NO2、6体积O2混合气体置于试管中,并将试管倒立于水槽中,充分反应后,剩余气体的体积是 ( )
A.1体积 B.2体积 C.3体积 4.4体积
19世纪,化学家对氧化锆的化学式有争议.经测定锆的相对原子质量为91,其氯化物蒸气的密度是同溶、同压下H2密度的116-117倍,试判断与氯化物价态相同的氧化锆的化学式 ( )
A.ZrO B.Zr2O C.Zr2O3 D.ZrO2
常温下,向20L真空容器中通入A mol硫化氢和 Bmol氯气(A,B均为不超过5的正整数),反应完全后,容器内气体可能达到的最大密度是 ( )
A.8.5 g·L-1 B.18.25g·L-1 C.18.5 g·L-1 D.35.5 g· L-1
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com