
【题目】Ⅰ.如图所示,U形管内盛有100mL的溶液,按要求回答下列问题:
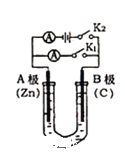
(1)打开K2 ,合并K1 ,若所盛溶液为CuSO4溶液: B极的电极反应式为 ______
(2)打开K1,合并K2,若所盛溶液为滴有酚酞的KCl溶液,则:总反应化学方程式是 __________________。
(3)反应一段时间后打开K2,若忽略溶液的体积变化和气体的溶解,B极产生气体的体积(标准状况)为11.2mL,将溶液充分混合,常温下溶液的pH约为 ________。若要使电解质溶液恢复到原状态,需向U形管内加入或通入一定量的 __________。
Ⅱ.CO用途广泛,工业应用时离不开平衡思想的指导:在某一容积为5L的体积不变的密闭容器内,加入0.3 mol 的CO和0.3mol的H 2O,在催化剂存在和800℃的条件下加热,发生如下反应:CO(g)+H20(g)![]() CO2(g)+H2(g) △H>0,反应中CO2的浓度随时间变化情况如下图:
CO2(g)+H2(g) △H>0,反应中CO2的浓度随时间变化情况如下图:
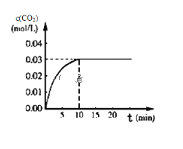
(1)根据图上数据,该温度(800℃)下的平衡常数K=____________________________。
(2)在体积不变的条件下,改变下列条件能使平衡常数K增大的有______________(填字母)
A.升高温度 B.降低温度 C.增大压强 D.减小压强 E.加入催化剂 G.移出一氧化碳气体
(3)若保持温度和容器的体积不变,在(1)中上述平衡体系中,再充入0.3mol的水蒸气,重新达到平衡后,H2O的转化率______________(填“升高”、“降低”、“不变”)。
(4)在催化剂和800℃的条件下,在某一时刻测得c(CO)=c(H2O)= 0.09mol·L-1;c(CO2)=c(H2)= 0.13 mol·L-1,则此时正、逆反应速率的大小:υ正_________υ逆(填“>”、“<”或“=”)。
【答案】Cu2+ + 2e- = Cu 2NaCl+2H 2 O![]() 2NaOH+H 2 ↑+Cl 2 ↑ 12 HCl 1 A 降低 <
2NaOH+H 2 ↑+Cl 2 ↑ 12 HCl 1 A 降低 <
【解析】
Ⅰ(1)、①该装置是原电池,锌作负极,碳作正极,正极上铜离子得电子生成铜发生氧化反应,据此书写电极反应方程式;
(2)、打开K1,合并K2,若所盛溶液为滴有酚酞的KCl溶液,该装置是电解池,碳棒是阳极,锌棒是阴极,电解时,锌棒上氢离子放电生成氢气,同时电极附近生成氢氧根离子导致溶液呈碱性,阳极B上氯离子放电生成氯气,阴极上氢离子放电生成氢气,同时溶液中生成氢氧化钾;
(3)、由(2)可知,B极产生(标准状况)为11.2mLCl2,生成0.001molKOH,故c(OH-)=0.01mol/L,c(H+)=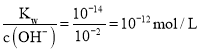 ,故pH=12;两极逸出的气体分别是H2和Cl2,故要使电解质溶液恢复到原状态,需向U形管内通入一定量的HCl气体;
,故pH=12;两极逸出的气体分别是H2和Cl2,故要使电解质溶液恢复到原状态,需向U形管内通入一定量的HCl气体;
Ⅱ(1)、根据CO2的浓度变化求出CO的浓度变化,再求反应速率,根据平衡常数指各生成物浓度的化学计量数次幂的乘积除以各反应物浓度的化学计量数次幂的乘积所得的比值进行解答;
(2)、平衡常数只随温度的变化而变化,根据温度对平衡的影响分析;
(3)、可逆反应中增大一种反应物的浓度,则另-种反应物的转化率会增大,而本身转化率减小;
(4)、根据![]() 与平衡常数K的大小关系判断。
与平衡常数K的大小关系判断。
Ⅰ(1)、①该装置是原电池,锌作负极,碳作正极,正极上铜离子得电子生成铜发生氧化反应,电极反应式为:Cu2+ + 2e- = Cu,故答案为:Cu2+ + 2e- = Cu;
(2)、打开K1,合并K2,若所盛溶液为滴有酚酞的KCl溶液,①该装置是电解池,碳棒是阳极,锌棒是阴极,电解时,锌棒上氢离子放电生成氢气,同时电极附近生成氢氧根离子导致溶液呈碱性,阳极B上氯离子放电生成氯气,阴极上氢离子放电生成氢气,同时溶液中生成氢氧化钾,所以电池反应式为2KCl+2H 2 O![]() 2KOH+H 2 ↑+Cl 2 ↑,故答案为:2KCl+2H 2 O
2KOH+H 2 ↑+Cl 2 ↑,故答案为:2KCl+2H 2 O![]() 2KOH+H 2 ↑+Cl 2 ↑;
2KOH+H 2 ↑+Cl 2 ↑;
(3)、由(2)可知,B极产生(标准状况)为11.2mLCl2,生成0.001molKOH,故c(OH-)=0.01mol/L,c(H+)=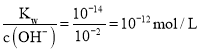 ,故pH=12;两极逸出的气体分别是H2和Cl2,故要使电解质溶液恢复到原状态,需向U形管内通入一定量的HCl气体,故答案为:12;HCl;
,故pH=12;两极逸出的气体分别是H2和Cl2,故要使电解质溶液恢复到原状态,需向U形管内通入一定量的HCl气体,故答案为:12;HCl;
Ⅱ(1)、在某一容积为5L的密闭容器内,加入0.3mol的CO和0.3mol的H2O,则起始浓度c(CO)=0.06mol/L,c(H2O)=0.06mol/L,平衡时c(CO2)=0.03mol/L,则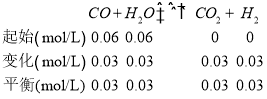 ,
,
![]() ,答案为:1;
,答案为:1;
(2)、平衡常数只随温度的变化而变化,已知CO(g) + H2O(g)= CO2(g) + H2(g) H> 0,则升高温度平衡正向移动,K增大,故答案为:A;
(3)、可逆反应中增大一种反应物的浓度,则另-种反应物的转化率会增大,而本身转化率减小,所以若保持温度和容器的体积不变,在(1)中上述平衡体系中,再充入0.3mol的水蒸气,重新达到平衡后,H2O的转化率降低,故答案为:降低;
(4)、在催化剂存在和800℃的条件下,在某一时刻测得c(CO)= c(H2O) = 0.09mol/L,c(CO2) = c(H2) = 0.13mol/L,![]() ,则反应逆向进行,则此时正、逆反应速率的大小:v正<v逆,故答案为:<。
,则反应逆向进行,则此时正、逆反应速率的大小:v正<v逆,故答案为:<。


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】某实验小组研究KI和酸性KMnO4溶液的反应。
实验序号 | Ⅰ | Ⅱ |
实验操作 |
|
|
实验现象 | 紫色褪去,溶液变为棕黄色 | 紫色溶液迅速变为棕褐色悬浊液,然后沉淀消失,溶液变为棕黄色 |
资料:i. MnO4— 在酸性条件下最终被还原为Mn2+。ii. 酸性条件下氧化性: KMnO4>KIO3>I2 。
(1)实验1中溶液呈棕黄色,推测生成了________。
(2)实验小组继续对实验II反应中初始阶段的产物成分进行探究:
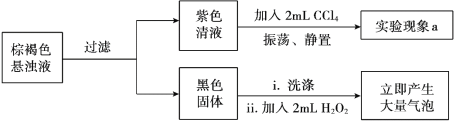
①经检验,实验II初始阶段I— 的氧化产物不是I2,则“实验现象a”为________。
②黑色固体是________。
③设计实验方案证明在“紫色清液”中存在IO3-:________。
④写出生成IO3-的离子方程式:________。
(3)探究实验II中棕褐色沉淀消失的原因。
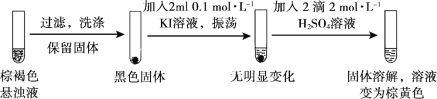
用离子方程式解释实验II中棕褐色沉淀消失的原因:________。
(4)实验反思:KI和酸性KMnO4溶液反应过程中,所得产物成分与________有关(写出两点即可)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】难溶性杂卤石(K2SO4MgSO42CaSO42H2O)属于“呆矿”,在水中存在如下平衡
K2SO4MgSO42CaSO42H2O(s)2Ca2++2K++Mg2++4![]() +2H2O
+2H2O
为能充分利用钾资源,用饱和Ca(OH)2溶液溶浸杂卤石制备硫酸钾,工艺流程如图1:
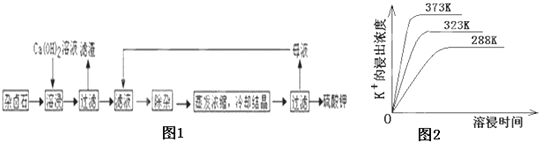
(1)滤渣主要成分有__________和___________以及未溶杂卤石.
(2)用化学平衡移动原理解释Ca(OH)2溶液能溶解杂卤石浸出K+的原因:_______________.
(3)“除杂”环节中,先加入_______溶液,经搅拌等操作后,过滤,再加入________溶液调滤液PH至中性.
(4)不同温度下,K+的浸出浓度与溶浸时间的关系是图2,由图可得,随着温度升高,①__________________________②______________________________;
(5)有人以可溶性碳酸盐为溶浸剂,则溶浸过程中会发生:CaSO4(s)+![]() CaCO3(s)+
CaCO3(s)+![]()
已知298K时,Ksp(CaCO3)=2.80×10﹣9,Ksp(CaSO4)=4.90×10﹣5,求此温度下该反应的平衡常数K_____________(计算结果保留三位有效数字).
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在给定的条件下,下列选项所示的物质间转化均能实现的是( )
A.MnO2![]() Cl2
Cl2![]() 漂白粉
漂白粉
B.Fe3O4![]() Fe
Fe![]() FeCl3溶液
FeCl3溶液
C.Al![]() NaAlO2
NaAlO2![]() Al(OH)3
Al(OH)3
D.饱和NaCl溶液![]() NaHCO3
NaHCO3![]() Na2CO3
Na2CO3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25 ℃时,醋酸和醋酸钠混合溶液中c(CH3COOH)、c(CH3COO-)二者之和为0.1 mol·L-1,同时溶液中c(CH3COOH)、c(CH3COO-)与pH值的关系如图所示。下列有关叙述正确的是( )
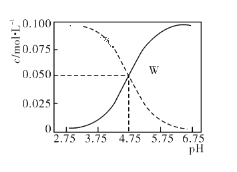
A.pH5.75和pH3.75的溶液中均符合:c(Na+)+c(H+)=c(CH3COO-)+c(OH-)
B.存在浓度关系 2c(Na+)=c(CH3COO-) +c(CH3COOH)的溶液对应图中W点
C.pH=5.75溶液中:c(CH3COOH)>c(Na+)>c(CH3COO-)>c(H+)>c(OH-)
D.根据图中数据,不能计算出25 ℃时醋酸的电离平衡常数
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某混合物浆液含Al(OH)3、MnO2和少量Na2CrO4。考虑到胶体的吸附作用使Na2CrO4不易完全被水浸出,某研究小组利用设计的电解分离装置(见图2),使浆液分离成固体混合物和含铬元素溶液,并回收利用。回答Ⅰ和Ⅱ中的问题。
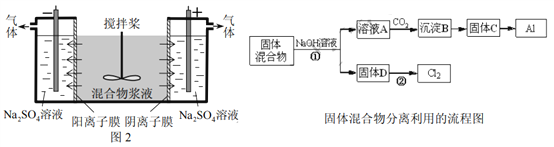
Ⅰ.固体混合物的分离和利用(流程图中的部分分离操作和反应条件未标明)
(1)反应①所加试剂NaOH的电子式为_________,B→C的反应条件为__________,C→Al的制备方法称为______________。
(2)该小组探究反应②发生的条件。D与浓盐酸混合,不加热,无变化;加热有Cl2生成,当反应停止后,固体有剩余,此时滴加硫酸,又产生Cl2。由此判断影响该反应有效进行的因素有(填序号)___________。
a.温度 b.Cl-的浓度 c.溶液的酸度
(3)0.1 mol Cl2与焦炭、TiO2完全反应,生成一种还原性气体和一种易水解成TiO2·xH2O的液态化合物,放热4.28 kJ,该反应的热化学方程式为__________。
Ⅱ.含铬元素溶液的分离和利用
(4)用惰性电极电解时,CrO42-能从浆液中分离出来的原因是__________,分离后含铬元素的粒子是_________;阴极室生成的物质为___________(写化学式)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学家们合成了一种新物质——五星烷,其键线式如图所示。下列有关五星烷的说法正确的是( )

A. 五星烷与乙烷互为同系物 B. 五星烷的化学式为C15H20
C. 五星烷的分子中含有7个五元环 D. 五星烷的一氯代物有3种
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】所下列化学用语的理解正确的是( )
A.比例模型![]() 既可以表示甲烷分子,也可以表示四氯化碳分子
既可以表示甲烷分子,也可以表示四氯化碳分子
B.电子式![]() H既可以表示羟基,也可以表示氢氧根离子
H既可以表示羟基,也可以表示氢氧根离子
C.丙烯的最简式可表示为CH2
D.结构简式(CH3)2CHCH3既可以表示正丁烷,也可以表示异丁烷
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:C(s) + H2O(g) =CO(g) + H2(g) ΔH=a kJ·mol-1
2C(s) +O2(g) =2CO(g) ΔH=-220 kJ·mol-1
H-H、O=O和O-H键的键能分别为436 kJ·mol-1、496 kJ·mol-1和462 kJ·mol-1,则a为( )
A.+332B.+118C.+350D.+130
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com