
红磷(P)和Cl2发生反应生成PCl3和PCl5,反应过程和能量的关系如下图所示,图中的ΔH表示生成1 mol产物的数据。已知PCl5分解生成PCl3和Cl2,该分解反应是可逆反应。下列说法正确的是( )
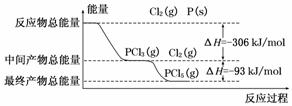
A.其他条件不变,降低温度有利于PCl5的生成
B.反应2P(s)+5Cl2(g)===2PCl5(g)对应的反应热 ΔH=-798 kJ/mol
C.P和Cl2反应生成PCl3的热化学方程式为:2P(s)+3Cl2(g)===2PCl3(g) ΔH=-306 kJ/mol
D.其他条件不变,对于2PCl5(g)===2P(s)+5Cl2(g) ΔH反应,增大压强,PCl5的转化率减小,ΔH减小
科目:高中化学 来源: 题型:
Cl2是纺织工业中常用的漂白剂,Na2S2O3可作为漂白布匹后的“脱氯剂”,S2O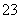 与Cl2反应的产物之一为SO
与Cl2反应的产物之一为SO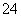 。下列说法中,错误的是( )
。下列说法中,错误的是( )
A.该反应中的氧化剂是S2O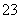
B.SO2与氯气的漂白原理相同,所以也可以用SO2作纺织工业的漂白剂
C.上述反应中,每生成1 mol SO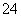 ,
, 可脱去2 mol Cl2
可脱去2 mol Cl2
D.根据该反应可判断还原性:S2O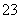 >Cl-
>Cl-
查看答案和解析>>
科目:高中化学 来源: 题型:
A、B、C、D、E、F六种短周期元素,其原子序数依次增大,其中B与C同周期,D与E和F同周期,A与D同主族,C与F同主族,C元素的原子最外层电子数是次外层电子数的三倍,D是所在周期原子半径最大的主族元素。又知六种元素所形成的常见单质在常温常压下有三种是气体,三种是固体。请回答下列问题:
(1)元素D在周期表中的位置__________。
(2)C、D、F三种元素形成的简单离子的半径由大到小的顺序是(用离子符号表示)______。
(3)由A、B、C三种元素以原子个数比4∶2∶3形成化合物X,X中所含化学键类型有________________________________________________________________________。
(4)若E是金属元素,其单质与氧化铁反应常用于焊 接钢轨,请写出反应的化学方程式:________________________________________________________________________。
接钢轨,请写出反应的化学方程式:________________________________________________________________________。
若E是非金属元素,其单质在电子工业中有重要应用,请写出其氧化物溶于强碱溶液的离子方程式:_______________ ___________________________________________________
___________________________________________________
_________________________________ _______________________________________。
_______________________________________。
(5)FC2气体有毒,排放到大气中易形成酸雨,写出FC2与氧气和水蒸气反应的化学方程式_____________________________________________________________________________
_______________ _________________________________________________________。
_________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
用系统命名法命名下列烷烃
(1) 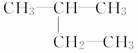 ______________________________________________;
______________________________________________;
(2) 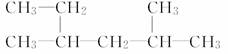 ___________________________________;
___________________________________;
(3) 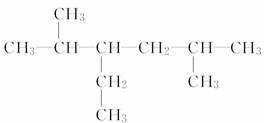 _______________________________;
_______________________________;
(4) 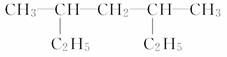 ___________________________________;
___________________________________;
(5) 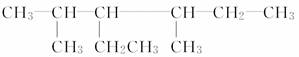 __________________________。
__________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
在系统命名法中下列碳原子主链名称是丁烷的是
( )
A.(CH3)2CHCH2CH2CH3 B.(CH3CH2)2CHCH3
C.(CH3)2CHCH(CH3)2 D.(CH3)3CCH2CH2CH3
查看答案和解析>>
科目:高中化学 来源: 题型:
甲、乙、丙、丁是中学常见的物质,其中甲、乙、丙均含有同一种元素,在一定条件下的转化关系如图,下列说法正确的是( )

A.若丁为用量最大,用途最广的金属单质,乙的溶液一定为FeCl3
B.若通常情况下甲、乙、丙、丁都是气体,且乙和丁为空气的主要成分,
则反应①的化学方程式4NH3+5O2 4NO+6H2O
4NO+6H2O
C.若甲、乙、丙的溶液显碱性,丙可作为医疗上治疗胃酸过多症的药剂,将等物质的
量的乙和丙溶于水形成混合溶液,溶液中各离子浓度由大到小的顺序为
c(Na+)>c(HCO3-)>c(CO32-)>c(OH-)> c(H+)
D.若丁为化合物,且为氯碱工业的重要产品,则甲一定为含Al3+的盐
查看答案和解析>>
科目:高中化学 来源: 题型:
已知2A2(g)+B2(g) 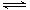 2C
2C 3(g);△H=-Q1 kJ/mol(Q1>0), 在一个有催化剂的固定容积的容器中加入2 molA2和1 molB2,在500℃时充分反应,达平衡后C3的浓度为w mol·L-1,放出热量为Q2 kJ。
3(g);△H=-Q1 kJ/mol(Q1>0), 在一个有催化剂的固定容积的容器中加入2 molA2和1 molB2,在500℃时充分反应,达平衡后C3的浓度为w mol·L-1,放出热量为Q2 kJ。
(1)达到平衡时, A2的转化率为________。
A2的转化率为________。
(2)达到平衡后,若向原容器中通入少量的氩气,A2的转化率将________(填“增大“、“减小”或“不变”)
(3)若在原来的容器中,只加入2mol C3,500℃时充分反应达平衡后,吸收热量Q3 kJ,C3浓度 (填>、=、<)w mol·L-1,Q1、Q2、Q3 之间满足何种关系
之间满足何种关系
(4)能说明该反应已经达到平衡状态的是 。
a.v(C3)=2 v (B2); b.容器内压强保持不变 
 c.2v逆(A2)=v正(B2) d.容器内的密度保持不变
c.2v逆(A2)=v正(B2) d.容器内的密度保持不变
(5)改变某一条件,得到如图的变化规律 (图中T表示温度,n表示物质的量),可得出的结论正确的是 ;
(图中T表示温度,n表示物质的量),可得出的结论正确的是 ;
a.反应速率c>b>a
b.达到平衡时A2的转化率大小为:b>a>c
c.T2>T1
d. b点A2和B2的物质的量之比为2:1
(6)若将上述容器改为恒压容器(反应前体积相同),起 始时加入2 molA2和l molB2,500℃时充分反应达平衡后,放出热量Q4 kJ,则Q2 Q4 (填“>”、“<”或“=”)。
始时加入2 molA2和l molB2,500℃时充分反应达平衡后,放出热量Q4 kJ,则Q2 Q4 (填“>”、“<”或“=”)。
(7)下列措施可以同时提高反应速率和B2的转化率是(填选项序号) 。
a.选择适当的催化剂 b .增大压强 c.及时分离生成的C3 d.升高温度
.增大压强 c.及时分离生成的C3 d.升高温度
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com