
【题目】我国学者近期发表在 Green Chemistry 的研究成果是将电解食盐水的阳极反应与电催化还原 CO2 的阴极反应相耦合,反应原理的示意图如图所示。下列说法错误的是
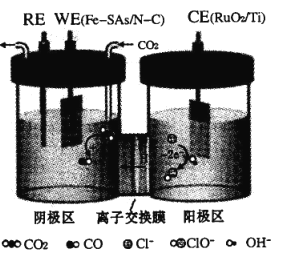
A.阳极反应为2Cl--2e- = Cl2↑
B.装置中的离子交换膜是质子交换膜
C.整个反应过程中碳、氯、氧的原子利用率接近 100%
D.这种耦合为提高 CO2 电化学还原的实际应用提供了思路
科目:高中化学 来源: 题型:
【题目】下列叙述正确的是( )
A. 1 mol H2SO4的质量为98g·mol-1
B. H2SO4的摩尔质量为98g
C. 6.02×1022个H2SO4分子的质量为9.8g
D. 9.8 g H2SO4含有6.02×1023个H2SO4分子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】3.2g铜与过量硝酸(8mol·L-1、30mL)充分反应,硝酸的还原产物为二氧化氮和一氧化氮,反应后溶液中含amol氢离子,则此时溶液中所含硝酸根离子的物质的量为( )
A.(0.2+a)molB.(0.1+a)mol
C.(0.05+a)molD.amol
【答案】B
【解析】
铜与浓硝酸可能发生反应的化学方程式:Cu+4HNO3(浓)=Cu(NO3)2+2NO2↑+2H2O,3Cu+8HNO3(稀)=3Cu(NO3)2+2NO↑+4H2O。硝酸铜的物质的量为![]() =0.05mol,溶液中所含硝酸根离子的物质的量为0.05mol×2+amol=(0.1+a)mol,故答案为B。
=0.05mol,溶液中所含硝酸根离子的物质的量为0.05mol×2+amol=(0.1+a)mol,故答案为B。
【点睛】
考查化学方程式的计算。注意浓硝酸和稀硝酸的性质的不同,明确二氧化氮或一氧化氮和硝酸的关系以及铜与硝酸(表现酸性)的关系式是解本题的关键。铜和硝酸反应,随着浓度的减少,硝酸的还原产物的价态越低,铜和浓硝酸反应生成NO2,而与稀硝酸反应时则生成NO,故生成的气体有NO2和NO,根据混合气体的物质的量可得被还原的硝酸的物质的量,根据生成硝酸铜的物质的量可知表现酸性的硝酸的物质的量。
【题型】单选题
【结束】
11
【题目】为了防止钢铁零件生锈,常采用化学处理使钢铁零件表面生成Fe3O4的致密保护层——“发蓝”。化学处理过程中其中一步的反应为3Fe+NaNO2+5NaOH=3Na2FeO2+H2O+NH3↑。下列叙述不正确的是( )
A.钢铁零件“发蓝”实质上是使铁表面钝化
B.上述反应中,铁被氧化
C.NO2-的氧化性大于FeO22-的氧化性
D.反应中转移2mol电子,生成还原产物8.5g
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在t℃时,Ag2CrO4(橘红色)在水溶液中的沉淀溶解平衡曲线如图所示.又知AgCl的Ksp=1.8×10-10。下列说法不正确的是( )
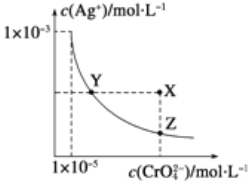
A. t℃时,Y点和Z点时Ag2CrO4的Ksp相等
B. 饱和Ag2CrO4溶液中加入K2CrO4不能使溶液由Y点变为X点
C. t℃时,Ag2CrO4的Ksp为1×10-8
D. t℃时,将0.01mol·L-1 AgNO3溶液滴入20mL0.01mol·L-1 KCl和0.01mol·L-1 K2CrO4的混合溶液中,Cl-先沉淀
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铁及其化合物是日常生活生产中应用广泛的材料,钛铁合金具有吸氢特性,在制造以氢为能源的热泵和蓄电池等方面有广阔的应用前景。请回答下列问题:
(l)基态铁原子的价电子轨道表达式(电子排布图)为____________________________;在基态Ti2+中,电子占据的最高能层具有的原子轨道数为____________。
(2)铁元素常见的离子有Fe2+和Fe3+,稳定性Fe2+___Fe3+(填“大于”或“小于”),原因是___________。
(3)纳米氧化铁能催化火箭推进剂NH4ClO4的分解,NH4+的结构式为(标出配位键)______________。
(4)金属钛采用六方最密堆积的方式形成晶体。则金属钛晶胞的俯视图为___________。
A.  B.
B. 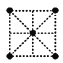 C.
C.  D.
D. 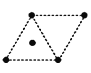
(5)氮化钛熔点高,硬度大,具有典型的NaCl型晶体结构,其晶胞结构如图所示。
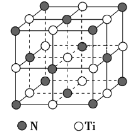
①设氮化钛晶体中Ti原子与跟它最邻近的N原子之间的距离为r,则与该Ti原子最邻近的Ti的数目为__________;
Ti原子与跟它次邻近的N原子之间的距离为____________。
②已知在氮化钛晶体中Ti原子的半径为a pm,N原子的半径为b pm,它们在晶体中是紧密接触的,则在氮化钛晶体中原子的空间利用率为____________。(用a、b表示)
③碳氮化钛化合物在汽车制造和航天航空领域有广泛的应用,其结构是用碳原子代替氮化钛晶胞顶点的氮原子,则这种碳氮化钛化合物的化学式为_____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某无色的混合气体甲中可能含有NO2、NO、CO2、O2、NH3、N2中的几种,将100mL甲气体经过如图所示的实验装置进行处理,结果得到酸性溶液,而几乎无气体剩余,则甲气体的组成为(不考虑Na2O2与NO2、NO的反应)( )

A.NO2、CO2、N2B.NH3、NO、CO2
C.NH3、N2、CO2D.NO、O2、NH3
【答案】B
【解析】
该气体无色,说明其中不含NO2;气体通过浓硫酸体积减小,说明其中有NH3;气体通过足量Na2O2后显红棕色,说明其中含有CO2和NO,故不含O2;最后通入水中无气体剩余,说明其中不存在N2,选项B正确,故答案为B。
【题型】单选题
【结束】
19
【题目】A、B、C、D是四种常见气体单质。E的相对分子质量比F小16,且F为红棕色。有关的转化关系如图所示(反应条件与部分反应的生成物略去)。

请回答下列问题:
(1)D的化学式为__,Y的化学式为__,E的化学式为__。
(2)Y与氧化铜反应,每生成1molB消耗3mol氧化铜,该反应的化学方程式为__。
(3)Y与E在一定条件下可反应生成B和Z,这是一个具有实际意义的反应,可消除E对环境的污染,该反应的化学方程式为__。
(4)气体F和气体SO2在通常条件下同时通入盛有BaCl2溶液的洗气瓶中(如图所示),洗气瓶中是否有沉淀生成?__,理由是__。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】小王同学在做实验时引发了镁失火,她立即拿起二氧化碳灭火器欲把火扑灭,却被实验老师及时制止。原因是CO2可以支持镁燃烧发生以下反应:2Mg+CO2![]() 2MgO+C,下列关于该反应的判断正确的是( )
2MgO+C,下列关于该反应的判断正确的是( )
A.Mg元素化合价由0价升高到+2价,所以MgO是还原产物
B.由此反应可以判断氧化性CO2>MgO,还原性Mg>C
C.CO2作氧化剂,表现氧化性,发生氧化反应
D.Mg原子得到的电子数目等于碳原子失去的电子数目
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA表示阿伏伽德罗常数的值。下列说法正确的是
A.由H218O与D216O组成的2.0g物质中所含中子、电子数均为NA
B.0.1molFe分别与足量的盐酸和氯气反应,转移的电子数均为0.2NA
C.0.1molAl与足量NaOH溶液反应,生成氢分子数为0.3NA
D.25℃,将0.1molCH3COONa加入稀醋酸至溶液呈中性时,溶液中CH3COO-数小于0.1NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关实验的选项正确的是 ( )
A.  X若为苯,可用于吸收NH3或HCl,并防止倒吸
X若为苯,可用于吸收NH3或HCl,并防止倒吸
B.  除去CO中的CO2
除去CO中的CO2
C.  可用于分离C2H5OH和H2O的混合物
可用于分离C2H5OH和H2O的混合物
D.  记录滴定终点读数为12.20 mL
记录滴定终点读数为12.20 mL
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com