
��1����֪���ױȰ����ȶ�����֪��4P(���ף�s��+5O2��g����2P2O5��s�� ��H1��
4P�����ף�s��+5O2��g����2P2O5��s�� ��H2����H1�ͦ�H2�Ĺ�ϵ�ǡ�H1 ��H2���������������
��������
��2����֪H2��g����CH3OH��l����ȼ���ȡ�H�ֱ�Ϊ-285.8kJ��mol-1��-726.5kJ��mol-1��д����CO2
��H2����Һ̬�״���Һ̬ˮ���Ȼ�ѧ����ʽ ��
��3����֪һ���¶��£����з�Ӧ��ƽ�ⳣ����SO2(g)+1/2O2(g)  SO3(g) K1,CO(g)+1/2O2(g)
SO3(g) K1,CO(g)+1/2O2(g)  CO2(g) K2������ͬ�¶��·�ӦSO2(g)+CO2(g)
CO2(g) K2������ͬ�¶��·�ӦSO2(g)+CO2(g)  SO3(g)+CO(g)��ƽ�ⳣ��Ϊ ��
SO3(g)+CO(g)��ƽ�ⳣ��Ϊ ��
����K1��K2��ʾ��
����6�֣��� ��2��3H2(g)��CO2(g)��CH3OH��l��H2O(l) ��H����130.9 kJ/mol ��3��
���������������1�����ױȰ����ȶ�����˵���������������ڰ�����������������ת��Ϊ���������ȷ�Ӧ����H��0�����ݷ�Ӧ��4P(���ף�s��+5O2��g����2P2O5��s�� ��H1�͢�4P�����ף�s��+5O2��g����2P2O5��s�� ��H2�����ݸ�˹���ɿ�֪���ڣ��ټ��õ���Ӧ4P�����ף�s����4P(���ף�s������÷�Ӧ�ġ�H����H2����H1��0�����ԡ�H1����H2��
��2��H2��g����CH3OH��l����ȼ���ȡ�H�ֱ�Ϊ-285.8kJ��mol-1��-726.5kJ��mol-1�����з�Ӧ��H2(g)��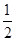 O2(g)��H2O(l) ��H����285.8kJ/mol����CH3OH��l����
O2(g)��H2O(l) ��H����285.8kJ/mol����CH3OH��l����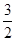 O2(g)��2H2O(l)��CO2(g) ��H����726.5kJ/mol������ݸ�˹���ɿ�֪���١�3���ڼ��õ���Ӧ3H2(g)��CO2(g)��CH3OH��l��H2O(l)����˸÷�Ӧ�ķ�Ӧ�ȡ�H����285.8kJ/mol��3��726.5kJ/mol����130.9 kJ/mol��
O2(g)��2H2O(l)��CO2(g) ��H����726.5kJ/mol������ݸ�˹���ɿ�֪���١�3���ڼ��õ���Ӧ3H2(g)��CO2(g)��CH3OH��l��H2O(l)����˸÷�Ӧ�ķ�Ӧ�ȡ�H����285.8kJ/mol��3��726.5kJ/mol����130.9 kJ/mol��
��3�����ݷ�Ӧ��SO2(g)+1/2O2(g)  SO3(g)����CO(g)+1/2O2(g)
SO3(g)����CO(g)+1/2O2(g) CO2(g)��֪���٣��ڼ��õ���ӦSO2(g)+CO2(g)
CO2(g)��֪���٣��ڼ��õ���ӦSO2(g)+CO2(g)  SO3(g)+CO(g)����������ͬ�¶��·�ӦSO2(g)+CO2(g)
SO3(g)+CO(g)����������ͬ�¶��·�ӦSO2(g)+CO2(g)  SO3(g)+CO(g)ƽ�ⳣ��K��
SO3(g)+CO(g)ƽ�ⳣ��K�� ��
��
���㣺���鷴Ӧ�ȵļ��㡢�Ȼ�ѧ����ʽ����д�Լ�ƽ�ⳣ���ļ����


 ��ǰ����ϵ�д�
��ǰ����ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�����Ѿ�����Ӱ�����ǵ����滷�����������糧�ͷų������ĵ������NOx������������Ͷ�����̼���������ɻ�����Ⱦ��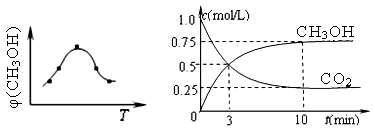
ͼ22-1 ͼ22-2 ͼ22-3
��1�����ü������ԭNOx��
��CH4(g) + 4NO2(g) =" 4NO(g)" + CO2(g) + 2H2O(g) ��H1=-574kJ?mol-1
��CH4(g) + 4NO(g) = 2N2(g) + CO2(g) + 2H2O(g) ��H2=-1160kJ?mol-1
����ֱ�ӽ�NO2��ԭΪN2���Ȼ�ѧ����ʽΪ ��
��2����CO2ת��Ϊ�״����Ȼ�ѧ����ʽΪ��
CO2(g) + 3H2(g) = CH3OH(g) + H2O(g) ��H3
��ȡ��ݵ����CO2��H2�Ļ�����壨���ʵ���֮�Ⱦ�Ϊ1��3�����ֱ�����¶Ȳ�ͬ���ݻ���ͬ�ĺ����ܱ������У�����������Ӧ����Ӧ��ͬʱ���ü״������������(CH3OH) �뷴Ӧ�¶�T�Ĺ�ϵ���ߣ���ͼ22-1����������CO2ת��Ϊ�״���Ӧ�ġ�H3 0�����������������=������
����һ���º����ܱ������г���1mol CO2��3mol H2������������Ӧ�����CO2��CH3OH��g����Ũ����ʱ��仯��ͼ22-2��ʾ��
����˵����ȷ���� ������ĸ���ţ���
| A����10min������������ٳ���1molCO2��3molH2�����ٴδﵽƽ��ʱc(CH3OH) ="1.5" mol/L |
| B���ﵽƽ��ʱ��������ת����Ϊ0.75 |
| C��0��10�����ڣ�������ƽ����Ӧ����Ϊ0.075mol/��L?min�� |
| D�����¶��£���Ӧ��ƽ�ⳣ����ֵΪ3/16 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
��ú��Ϊȼ�Ͽ�ͨ����������;����
;��I��C(s) +O2 (g)=CO2(g) ��H1<0 ��
;��II�����Ƴ�ˮú����C(s) +H2O(g)=CO(g)+H2(g) ��H2>0 ��
��ȼ��ˮú����2CO(g)+O2 (g)=2CO2(g) ��H3<0 ��
2H2(g)+O2 (g)=2H2O(g) ��H4<0 ��
��ش��������⣺
��1��;��I�ų������� ( ����ڡ������ڡ���С�ڡ�) ;��II�ų���������ԭ���� ��
��2����H1����H2����H3����H4����ѧ��ϵʽ�� ��
��3��12g̿���������в���ȫȼ������һ����̼���ų�110.35kJ���������Ȼ�ѧ����ʽΪ ��
��4��ú̿��Ϊȼ�ϲ���;��II���ŵ���
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
��2L�ܱ������м���һ������A��B��C�������壬һ�������·�����Ӧ�������ʵ����ʵ�����ʱ��仯��ͼ����ʾ[t0��15 s��n(B)δ����]��ͼ��Ϊt2ʱ�̺�ı�����ƽ����ϵ�з�Ӧ������ʱ��仯����������ĸ������ı�������������ͬ����֪t3��t4��Ϊʹ�ô������۲���ͼ���ش��������⣺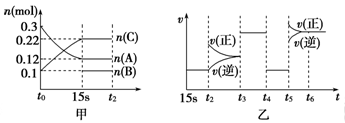
(1)��ͼ�дӷ�Ӧ���ﵽƽ��״̬��������C��ƽ����Ӧ����Ϊ____________________��
(2)ͼ����t2ʱ����ƽ���ƶ���������______��t5ʱ����ƽ���ƶ���������_______��������ţ�
A�������¶� B������Ӧ��Ũ�� C��ʹ�ô��� D��������ϵѹǿ
(3)ͼ���б�ʾƽ�������У������ĸ�����C�����ʵ�����ߵ�һ��ʱ����______��(�����)�� A��15s-t2ʱ�� B��t3-t4ʱ�� C��t4-t5ʱ�� D��t6�Ժ�
(4)�÷�Ӧ�Ļ�ѧ����ʽ���Ա�ʾΪ��_______________________________________________________��
����ӦΪ______________(����ȡ������ȡ�)��Ӧ��
(5)��Ӧ��ʼʱ�����B�����ʵ���Ϊ________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
��������һ����Ҫ�����ȼ�ϣ�Ҳ�������������������ȣ��Գ��������ƻ����á���ҵ�Ͽ�����ú���������ˮú�����ϳɶ�����( CH3OCH3)����ش��������⣺
(1)����ˮú���ϳɶ����ѵ�������Ӧ���£�
��2H2(g)+CO(g) CH3OH(g) ��H= ��90��8kJ/mol
CH3OH(g) ��H= ��90��8kJ/mol
��2CH3OH(g) CH3OCH3(g)+H2O(g) ��H=��23��5kJ/mol
CH3OCH3(g)+H2O(g) ��H=��23��5kJ/mol
��CO(g)+H2O(g) CO2(g)+H2(g) ��H=��41��3kJ/mol
CO2(g)+H2(g) ��H=��41��3kJ/mol
�ܷ�Ӧ��3H2(g)+3CO(g) CH3OCH3(g)+CO2(g) �ġ�H= ��
CH3OCH3(g)+CO2(g) �ġ�H= ��
һ�������µ��ܱ������У����ܷ�Ӧ�ﵽƽ�⣬Ҫ���CO��ת���ʣ����Բ�ȡ�Ĵ�ʩ�ǣ�
________������ĸ���ţ���
a��ѹ����� b��������� c������CO2��Ũ�� d������CO��Ũ��
e������������ѣ�CH3OCH3��
(2)��֪��Ӧ��2CH3OH(g) CH3OCH3(g)+H2O(g) ��H=��23��5kJ/mol
CH3OCH3(g)+H2O(g) ��H=��23��5kJ/mol
ij�¶��µ�ƽ�ⳣ��Ϊ400�����¶��£����ܱ������м���CH3OH����Ӧ��ijʱ�̲�ø���ֵ�Ũ�����£�
| ���� | CH3OH | CH3OCH3 | H2O |
| Ũ�ȣ�mol��L-1�� | 0��40 | 0��6 | 0��6 |
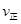 _________
_________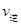 ���>������<����=������
���>������<����=�������鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�����Ѿ����Ƴ��Ա���Ϊȼ�ϵ�����ȼ�ϵ�أ������Ϊ����̼���Σ�����ܷ�Ӧ����ʽΪ��C3H8+5O2=3CO2+4H2O��
��1����֪��2C3H8��g��+7O2��g��=6CO��g��+8H2O��l��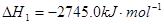
C��s��+O2��g��=CO2��g�� 
2C��s��+O2��g��=2CO��g�� 
��ӦC3H8��g��+5O2��g��=3CO2��g��+4H2O��1���ġ�H___________________��.
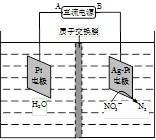
��2���õ�ص�����ͨ��O2��CO2������ͨ����飬�������ĵ缫��ӦʽΪ_________________����ع���ʱCO32������_____________����
��3���øõ�ص��1L 1 mol��L��1��AgNO3��Һ���˵��ط�Ӧ�Ļ�ѧ����ʽΪ______________________�����õ������0.005molC3H8ʱ��������Һ��pHΪ__________����Һ����仯���Բ��ƣ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�ݱ�����һ���������ɶ�����̼�������ϳ��Ҵ��ѳ�Ϊ��ʵ��
��֪����CH3CH2OH(l)+3 O2 (g)=2CO2(g)+3H2O(l) ��H="-1366.8" kJ/mol
��2H2 (g)+O2 (g)=2H2O(l) ��H="-571.6" kJ/mol
��1��д����CO2��H2 ��Ӧ�ϳ�CH3CH2OH (l)��H2O(l)���Ȼ�ѧ����ʽ ��
��2�������Ҵ�ȼ�ϵ���״��棬���ƹ㣬�Ի�����ȾС�����зdz������ķ�չǰ������ȼ�ϵ���У�ʹ�ò����缫��KOH��Һ���������Һ��ͨ���Ҵ�ȼ����һ��Ϊ �����ü��ϵĵ缫��ӦʽΪ ��
��3�����Ҵ�ȼ�ϵ�ص��400 mL ����ʳ��ˮװ�ÿɼ�ʾ����ͼ��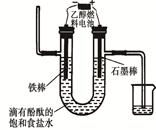
��װ���з�����ⷴӦ�ķ���ʽΪ �������������۲쵽�������� ������������448 mL���壨����ڱ�״���²�ã�ʱ��ֹͣ��⣬���������Һ��Ͼ��ȣ���Һ��pHΪ ����������������ܽ⼰��Һ����ı仯��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�����״���ԭ��CO��H2�������з�Ӧ��ȡ��CH4��g��+H2O��g�� CO��g��+3H2��g�����Իش��������⡣
CO��g��+3H2��g�����Իش��������⡣
��1����֪���� CH4��g��+3/2 O2��g�� CO��g��+2H2O��g����Hl��
CO��g��+2H2O��g����Hl��
�� H2��g��+1/2 O2��g�� H2O��g�� ��H2��
H2O��g�� ��H2��
��CH4��g��+ H2O��g�� CO��g��+3H2��g���ġ�H��____ ���ú���H1����H2��ʽ�ӱ�ʾ��
CO��g��+3H2��g���ġ�H��____ ���ú���H1����H2��ʽ�ӱ�ʾ��
��2��һ�������·�ӦCH4��g��+H2O��g�� CO��g��+3H2��g����CH4��ƽ��ת�������¶ȡ�ѹǿ�Ĺ�ϵ��ͼ����T2>T1�� ��������Ӧ�ġ�H____ 0���<������>������=������ͬ����A��B����Ӧƽ�ⳣ����KA��KB���Ĵ�С��ϵΪKA____ KB
CO��g��+3H2��g����CH4��ƽ��ת�������¶ȡ�ѹǿ�Ĺ�ϵ��ͼ����T2>T1�� ��������Ӧ�ġ�H____ 0���<������>������=������ͬ����A��B����Ӧƽ�ⳣ����KA��KB���Ĵ�С��ϵΪKA____ KB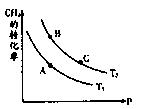
��3��ά���¶�T2����0.04 mol CH4��0.04mol H2O��g��ͨ���ݻ�Ϊ1L�Ķ����ܱ������з�����Ӧ��ƽ��ʱ�ﵽB�㣬���CH4��ת����Ϊ50%,�÷�Ӧ�ڴ��¶��µ�ƽ�ⳣ��KB=____ ������������˵���÷�Ӧ�Ѿ��ﵽƽ��״̬����_ ___
a��������CH4��H2O��CO��H2�����ʵ���֮��Ϊ1��1��1��3
b���������ܶȺ㶨
c��������ѹǿ�㶨
d��3������CO������������H2��
��4��������B��ƽ������ϣ�����������ͨ��amol CH4��a mol H2O���壬ʹ֮��C�����´�ƽ�⣬��ʱ���CO��0.03mol����a=____ ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
������һ����ࡢ��Ч��������Դ��
I.�ü�����ȡ�����ķ�Ӧ��Ϊ�������������仯����ͼ��ʾ��
��1�������ˮ������Ӧ���ɶ�����̼���������Ȼ�ѧ����ʽ�� ��
II.���ݻ�Ϊ1L���ܱ������ڣ�����0.1molCO��0.1molH2O���ڴ������ڵ������¸��¼���ʹ�䷴Ӧ�����CO2��Ũ����ʱ��仯��ͼ����ͼ��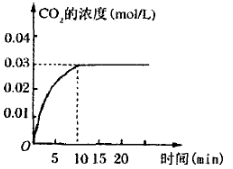
��2���ڸ��¶��£��ӷ�Ӧ��ʼ���ﵽƽ��ʱ��CO��ƽ����Ӧ����Ϊ ��
��3�����¶��£��˷�Ӧ�Ļ�ѧƽ�ⳣ��Ϊ�������÷�����ʾ�� ��
��4�����иı��У���ʹƽ��������Ӧ�����ƶ����� ��
| A�������¶� | B������ѹǿ |
| C������H2O��g����Ũ�� | D������CO2��g����Ũ�� |
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com