
 D.CH3-CH2-CH2-CH3和
D.CH3-CH2-CH2-CH3和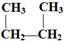 E.液氯和氯气 F.CO(NH2)2和NH4CNOG.C60和金刚石
E.液氯和氯气 F.CO(NH2)2和NH4CNOG.C60和金刚石分析 A.O2和O3 是氧元素构成的两种不同单质;
B.12C和13C均是碳元素的不同种原子;
C.CH3-CH2-CH2-CH3和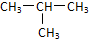 ,属于分子式相同,结构不同的有机化合物;
,属于分子式相同,结构不同的有机化合物;
D.CH3-CH2-CH2-CH3和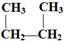 都是正丁烷;
都是正丁烷;
E.液氯和氯气均是氯气单质;
F.CO(NH2)2和NH4CNO,是分子式相同,结构不同的化合物;
G.C60和金刚石均是碳元素形成的单质,据此解答即可.
解答 解:(1)同位素是质子数相同中子数不同的同元素的不同核素互称同位素,故答案为:B;
(2)同种元素组成的不同单质为同素异形体,故答案为:AG;
(3)分子式相同,结构不同的物质为同分异构体,故答案为:CF;
(4)D.H2O和D2O均是有H与O构成的化合物水,属于一种物质,E.液氯和氯气是氯气的两种状态,属于一种物质,故答案为DE.
点评 本题考查了有机物的命名方法应用,同位素、同素异形体、同系物、同分异构体概念的理解和判断是解题的关键.


 期末好成绩系列答案
期末好成绩系列答案 99加1领先期末特训卷系列答案
99加1领先期末特训卷系列答案 百强名校期末冲刺100分系列答案
百强名校期末冲刺100分系列答案科目:高中化学 来源: 题型:解答题

 +H2O$→_{△}^{H+}$
+H2O$→_{△}^{H+}$ +CH3CH2OH.M与新制氢氧化铜悬浊液反应的化学方程式CH3CHO+2Cu(OH)2$\stackrel{△}{→}$CH3COOH+Cu2O↓+2H2O
+CH3CH2OH.M与新制氢氧化铜悬浊液反应的化学方程式CH3CHO+2Cu(OH)2$\stackrel{△}{→}$CH3COOH+Cu2O↓+2H2O 、
、 、
、 、
、 、
、 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.125mol | B. | 0.375mol | C. | 0.5mol | D. | 0.75mol |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
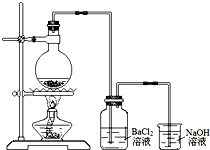 某学习小组探究铜跟浓硫酸反应的情况.取6.4g铜片和10mL 18mol•L-1的浓硫酸放在圆底烧瓶中,按右图所示装置进行实验.
某学习小组探究铜跟浓硫酸反应的情况.取6.4g铜片和10mL 18mol•L-1的浓硫酸放在圆底烧瓶中,按右图所示装置进行实验.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 目前研究菠菜蛋白质“发电”不属于“太阳能文明” | |
| B. | 发展太阳能经济有助于减缓温室效应 | |
| C. | 太阳能电池可将太阳能转化为电能 | |
| D. | 石油和天然气都属于碳素燃料 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
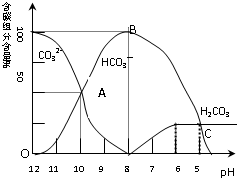 常温下在20mL0.1mol/L碳酸钠溶液中逐滴加入0.1mol/L盐酸40mL,溶液的pH逐渐降低,此时溶液中含碳元素的微粒的百分含量也发生变化(二氧化碳因为逸出未画出).据此回答下列问题:
常温下在20mL0.1mol/L碳酸钠溶液中逐滴加入0.1mol/L盐酸40mL,溶液的pH逐渐降低,此时溶液中含碳元素的微粒的百分含量也发生变化(二氧化碳因为逸出未画出).据此回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 据能量守恒定律,反应物的总能量一定等于生成物的总能量 | |
| B. | 只要有能量的变化,一定发生了化学反应 | |
| C. | 所有的化学反应都有能量变化 | |
| D. | 需要加热才能发生的反应一定是吸热反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 分子组成中相差一个或几个CH2 原子团的有机物是同系物 | |
| B. | 各组成元素质量分数相同的烃是同一种烃 | |
| C. | 分子式相同而结构不同的有机物不一定是同分异构体 | |
| D. | 互为同系物的有机物其分子结构必然相似 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com