
【题目】甲、乙两个研究性学习小组为测定氨分子中氮、氢原子个数比,设计如下实验流程:

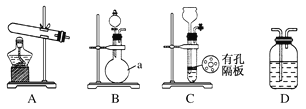
实验中,先用制得的氨气排尽洗气瓶前所有装置中的空气,再连接洗气瓶和气体收集装置,立即加热氧化铜。反应完毕后,黑色的氧化铜转化为红色的铜(2NH3+3CuO![]() N2+3Cu+3H2O)。下图A、B、C为甲、乙两小组制取氨气时可能用到的装置,D为盛有浓硫酸的洗气瓶。
N2+3Cu+3H2O)。下图A、B、C为甲、乙两小组制取氨气时可能用到的装置,D为盛有浓硫酸的洗气瓶。
甲小组测得,反应前氧化铜的质量m1 g、氧化铜反应后剩余固体的质量m2 g、生成氮气在标准状况下的体积V1 L。乙小组测得,洗气前装置D的质量m3 g、洗气后装置D的质量m4 g、生成氮气在标准状况下的体积V2 L。
请回答下列问题:
(1)写出仪器a的名称:________。
(2)甲、乙两小组选择了不同的方法制取氨气,请将实验装置的字母编号和制备原理填在下表空格中。
实验装置 | 实验药品 | 制备原理 | |
甲小组 | A | 氢氧化钙、 硫酸、硫酸铵 | 反应的化学方程式为①____________ |
乙小组 | ②______ | 浓氨水、氢氧化钠 | 氢氧化钠溶于氨水后放热,增加氢氧根离子浓度,加快氨气逸出 |
(3)甲小组用所测得数据计算出氨分子中氮、氢的原子个数之比为________。
(4)乙小组用所测得数据计算出氨分子中氮、氢的原子个数比明显小于理论值,其原因是_________。
【答案】 圆底烧瓶 (NH4)2SO4+Ca(OH)2![]() 2NH3↑+2H2O+CaSO4 B 5V1∶7(m1m2) 浓硫酸吸收了未反应的氨气,从而使计算的氢的含量偏高
2NH3↑+2H2O+CaSO4 B 5V1∶7(m1m2) 浓硫酸吸收了未反应的氨气,从而使计算的氢的含量偏高
【解析】
(1)仪器a是圆底烧瓶。
(2)①仿照氯化铵与碱石灰混合加热制取氨气,即可写出相应的化学方程式为(NH4)2SO4+Ca(OH)2![]() 2NH3↑+2H2O+CaSO4②浓氨水与固体氢氧化钠混合即可制得氨气,且两种物质混合后就无法控制反应随关随停,不需要选用C装置,选用B装置即可。
2NH3↑+2H2O+CaSO4②浓氨水与固体氢氧化钠混合即可制得氨气,且两种物质混合后就无法控制反应随关随停,不需要选用C装置,选用B装置即可。
(4)根据2NH3+3CuO![]() N2+3Cu+3H2O可知减少的质量等于生成物水中氧元素的质量,
N2+3Cu+3H2O可知减少的质量等于生成物水中氧元素的质量,![]()
![]()
化简的n(N):n(H)=5V1∶7(m1m2);
(5)浓硫酸吸收了未反应的氨气,从而使计算的氢的量偏高 ,可以选用不吸收氨气只吸收水的碱石灰、氢氧化钠、氧化钙等干燥剂。


 学期复习一本通学习总动员期末加暑假延边人民出版社系列答案
学期复习一本通学习总动员期末加暑假延边人民出版社系列答案 芒果教辅暑假天地重庆出版社系列答案
芒果教辅暑假天地重庆出版社系列答案科目:高中化学 来源: 题型:
【题目】氮族元素和硼族元素在生产生活中有很重要的地位。
(1)写出硼族元素Ga的基态原子核外电子排布式_________________。
(2)NF3的分子构型为__________,NO3-的空间构型为______,1molNO3-中含有的σ键的数目为:_________。
(3)氮化硼的立方结晶的变体被认为是已知的最硬的物质。BN的晶体结构与金刚石相似,其中B原子的杂化方式________。
(4)元素第一电离能的大小:As______(填“”或“=”)Ga,原因是__________。
(5)相同条件下,在水中的溶解度:NH3(填“”或“=”)PH3,原因是__________。
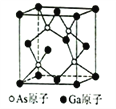
(6)已知立方砷化镓晶胞的结构如图所示,其晶胞边长为cpm。则砷化镓的化学式为________,晶胞中As原子和它最近的Ga原子之间的距离为_______pm(用含c的式子表示),砷化镓的密度为_______g/cm3(设NA为阿伏加德罗常数的值,用含c、NA的式子表示,原子量:Ga-70,As-75)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)1.00L 1.00molL﹣1H2SO4溶液与2.00L 1.00molL﹣1 NaOH溶液完全反应,放出114.6kJ热量,该反应的中和热△H为_____,表示其中和热的热化学方程式为_____.
(2)在25℃、101KPa时,1.00g C6H6(l)燃烧生成CO2(g)和H2O(l),放出41.8kJ的热量,C6H6的燃烧热为_____KJmol﹣1,该反应的热化学方程式为_____.
(3)化合物AX3和单质X2在一定条件下反应可生成化合物AX5.回答下列问题:
已知AX3的熔点和沸点分别为﹣93.6℃和76℃,AX5的熔点为167℃.室温时AX3与气体X2反应生成1mol AX5,放出热量123.8kJ.该反应的热化学方程式为_____.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】CH4和H2O(g)可发生催化重整反应:CH4(g)+H2O(g)![]() CO(g)+3H2(g)。
CO(g)+3H2(g)。
(1)每消耗8g CH4转移的电子的数目为 。
(2)已知:①2CO(g)+O2(g)=2CO2(g) △H1=akJ·mol-1
②CO(g)+H2O(g)=CO2(g)+H2(g) △H2=bkJ·mol-1
③CH4(g)+2O2(g)=CO2(g)+2H2O(g) △H3=ckJ·mol-1
④CH4(g)+H2O(g)![]() CO(g)+3H2(g) △H4
CO(g)+3H2(g) △H4
由此计算△H4= kJ·mol-1。
(3)T℃时,向1L恒容密闭容器中投入1molCH4和1molH2O(g),发生反应:CH4(g)+H2O(g)![]() CO(g)+3H2(g),经过tmin,反应达到平衡。已知平衡时,c(CH4)=0.5mol·L-1。
CO(g)+3H2(g),经过tmin,反应达到平衡。已知平衡时,c(CH4)=0.5mol·L-1。
①0~tmin内,该反应的平均反应速率v(H2)= 。②T℃时,该反应的平衡常数K= 。
③当温度升高到(T+100)℃时,容器中c(CO)="0.75" mol·L-1,则该反应是 反应(填“吸热”或“放热”)。
(4)已知熔融碳酸盐燃料电池的工作原理示意图如下:
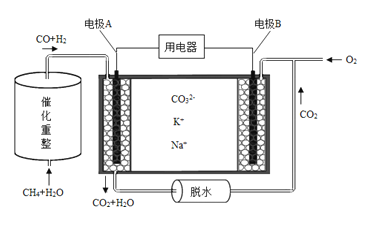
①放电过程中K+和Na+向电极 (填“A”或“B”)移动。
②该电池的负极反应式为 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某研究小组制备84消毒液(主要成分NaClO)设计了如图装置。并查阅到下列资料,“在加热情况下卤素与碱液发生如下反应:3X2+6OH![]() 5X+XO3—+3H2O”。
5X+XO3—+3H2O”。

回答下列问题:
(1)装置中的大试管内发生反应的离子方程式为_______________________。
(2)装置中能否省去盛饱和NaCl溶液的洗气瓶?_____(填“能”或“不能”,下同),理由是_____________。
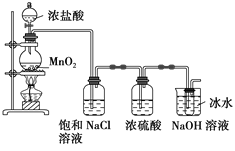
(3)装置中能否省去盛浓硫酸的洗气瓶?________,理由是____________________________。
(4)装置中能否省去盛冰水的烧杯?________,理由是______________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某蓝色电解质溶液中,只可能大量存在有H+、Cu2+、CO32-、OH-、Cl-等离子,你认为一定有的离子是______________,一定没有的离子是_____________,还需进一步确认的_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上利用氢氧化锂(含有少量氢氧化镁)制备四氟硼酸锂流程如下:
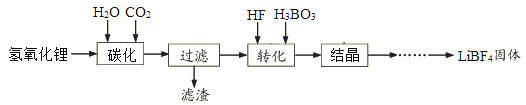
已知:碳酸锂难溶于水。
(1)碳化时发生的主要离子方程式为___________________________。滤渣的主要成分___________。(写化学式)载人宇宙飞船选用氢氧化锂吸收CO2,而不用价格更便宜的氢氧化钠,其主要原因____________。
(2)转化过程发生的反应为连续的两步,分别为LiHCO3+4HF=LiF·3HF+H2O+CO2↑,______________(写化学方程式)。该过程中不能采用玻璃器皿,其原因为________________________。
(3)结晶得到的晶体LiBF4·H2O需先在20℃~50℃干燥,后在150℃干燥,在150℃干燥的目的是_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学兴趣小组为探究SO2的性质,按下图所示装置进行实验。(已知:Na2SO3+H2SO4===Na2SO4+SO2↑+
H2O)
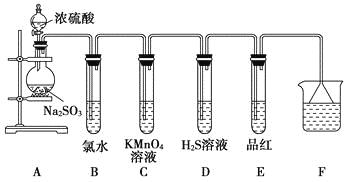
请回答下列问题:
(1)装置A中盛放浓硫酸和亚硫酸钠的仪器名称分别是________、________。
(2)反应后,装置B中发生的现象是_________________________________;反应的离子方程式为______________________________;装置C中的现象是___________________________,表现了SO2的________;装置D中现象是_____________________________________________,发生反应的化学方程式为_________________________________________。
(3)装置E的目的是探究SO2与品红作用的可逆性,请写出实验操作及现象_________________________。
(4)F装置的作用是________________________,漏斗的作用是___________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】通常把断裂1 mol某化学键所吸收的能量称为键能。键能的大小可以衡量化学键的强弱,也可以估算化学反应的反应热(用△H表示,放热反应的△H<0,吸热反应的△H>0),△H=反应物总键能-生成物总键能。
已知:N-N键、H-H键和N-H键的键能分别记作a、b和c(单位:kJ·mol-1),合成氨反应的能量变化关系如图所示。回答下列问题:
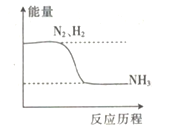
(1)合成氨反应的化学方程式为___。
(2)NH3分解生成N2和l mol H2要____(填“吸收”或“放出”)___热量(用含a、b、c的代数式表示)kJ。
(3)事实上,反应的热量总小于理论值,原因可能是________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com