

分析 由元素在周期表中位置,可知①为C、②为N、③为O、④为Na、⑤为Al、⑥为S、⑦为Cl、⑧为Ar、⑨为K.
(2)氯气与氢氧化钠反应生成氯化钠、次氯酸与水;
氧化铝与氢氧化钠反应生成偏铝酸钠与水;
硫在氯气中燃烧生成二氧化硫.
解答 解:由元素在周期表中位置,可知①为C、②为N、③为O、④为Na、⑤为Al、⑥为S、⑦为Cl、⑧为Ar、⑨为K.
(1)①为C,名称为碳,②为N,名称为氮,⑧为Ar,名称为氩,⑨为K,名称为钾,
故答案为:C、碳;N、氮;Ar、氩;K,钾;
(2)氯气与氢氧化钠反应生成氯化钠、次氯酸与水,反应方程式为:Cl2+2NaOH═NaCl+NaClO+H2O,
氧化铝与氢氧化钠反应生成偏铝酸钠与水,反应方程式为:Al2O3+2NaOH═2NaAlO2+H2O,
硫在氯气中燃烧生成二氧化硫,反应方程式为:S+O2$\frac{\underline{\;点燃\;}}{\;}$SO2,
故答案为:Cl2+2NaOH═NaCl+NaClO+H2O;Al2O3+2NaOH═2NaAlO2+H2O;S+O2$\frac{\underline{\;点燃\;}}{\;}$SO2.
点评 本题考查元素周期表与元素化合物性质,侧重对化学用语的考查,题目贴近教材,基础性强.


 新题型全程检测期末冲刺100分系列答案
新题型全程检测期末冲刺100分系列答案科目:高中化学 来源: 题型:填空题
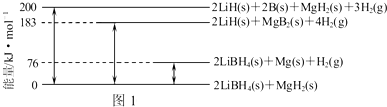
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
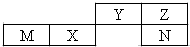 五种短周期元素在元素周期表中的位置如图,其中只有一种为金属元素.下列说法正确的是( )
五种短周期元素在元素周期表中的位置如图,其中只有一种为金属元素.下列说法正确的是( )| A. | 简单离子半径大小:M>N>Z | |
| B. | 最简单气态氢化物的沸点高低:N>Z>Y | |
| C. | M的最高价氧化物可与N的最高价氧化物对应水化物反应 | |
| D. | N单质可与Z的最简单氢化物反应置换出Z单质 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
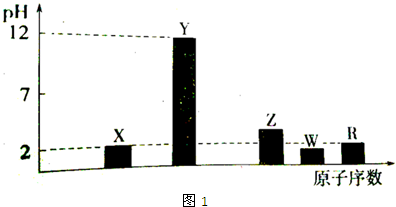
 .
.
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 大于10.00mL | B. | 小于10.00Ml | C. | 等于10.00mL | D. | 不能确定 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
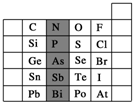 元素在周期表中的位置,反映了元素的原子结构和元素的性质.如图是元素周期表的一部分.
元素在周期表中的位置,反映了元素的原子结构和元素的性质.如图是元素周期表的一部分.查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | PH值一定为5 | B. | 一定是酸溶液 | ||
| C. | 可能是强酸的酸式盐溶液 | D. | PH值可能为9 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 水是强电解质 | B. | 25℃时,纯水的pH=7 | ||
| C. | 可燃冰是可以燃烧的水 | D. | 氢氧两种元素只能组成水 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com