
| A. | 原子序数:X>Y>Z>W | |
| B. | 离子半径:W>X>Z | |
| C. | W分别与Y、Z形成的化合物中化学键类型不同 | |
| D. | 气态氢化物的稳定性:W<Y |
分析 短周期元素W、X、Y、Z,W是地壳中含量最多的元素,则W是O,X的氧化物具有两性,则X是Al,Z原子的半径是所在周期中最大的,则Z是Na,X、Y、Z处于同一周期,则Y在第三周期,Y的最高正价与最低负价的代数和为0,根据最高正价与最低负价的绝对值之和等于8可知,Y的最高正价为+4价,则Y为Si,结合元素周期律解答.
解答 解:短周期元素W、X、Y、Z,W是地壳中含量最多的元素,则W是O,X的氧化物具有两性,则X是Al,Z原子的半径是所在周期中最大的,则Z是Na,X、Y、Z处于同一周期,则Y在第三周期,Y的最高正价与最低负价的代数和为0,根据最高正价与最低负价的绝对值之和等于8可知,Y的最高正价为+4价,则Y为Si,
A.原子序数:Y(Si)>X(Al)>Z(Na)>W(O),故A错误;
B.电子层结构相同,序小半径反而大,则W(O2-)>Z(Na+)>X(Al3+),故B错误;
C.W分别与Y形成共价化合物SiO2,W与Z形成的离子化合物Na2O,Na2O2,化学键类型不同,故C正确;
D.非金属性W(O)>Y(Si),气态氢化物的稳定性:W(O)>Y(Si),故D错误;
故选:C.
点评 本题考查结构性质位置关系应用,元素的推断是解题关键,注意对元素周期律的理解.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
| A. | Li-Al在电池中作为负极材料,该材料中Li的化合价为+l价 | |
| B. | 用水作电解质溶液 | |
| C. | 该电池的电池反应式为:2Li+FeS═Li2S+Fe | |
| D. | 充电时,阴极发生的电极反应式为:Li2S+Fe-2e-═2Li++FeS |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
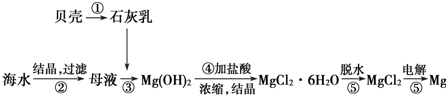
| A. | 用此法提取镁的优点之一是原料来源丰富 | |
| B. | 电解MgCl2时阳极产生镁 | |
| C. | 步骤⑤可将晶体置于HCl气体氛围中脱水制无水氯化镁 | |
| D. | 上述工艺流程中涉及到化合、分解和复分解反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
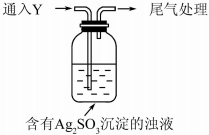 某学生对Na2SO3与AgNO3在不同pH下的反应进行探究.
某学生对Na2SO3与AgNO3在不同pH下的反应进行探究.| 实验 | pH | 现象 |
| A | 10 | 产生白色沉淀,稍后溶解,溶液澄清 |
| B | 6 | 产生白色沉淀,一段时间后,沉淀未溶解 |
| C | 2 | 产生大量白色沉淀,一段时间后,产生海绵状棕黑色物质X |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | X、W、U的最高价氧化物对应的水化物酸性由强到弱的顺序为:U>W>X | |
| B. | Y、Z元素的单质作电极,在氢氧化钠溶液中构成原电池,Z电极上产生大量气泡 | |
| C. | 室温下,0.05.mol•L-1U的气态氢化物的水溶液的pH>1 | |
| D. | Y、Z、U元素的简单离子半径由大到小的顺序:Y>Z>U |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
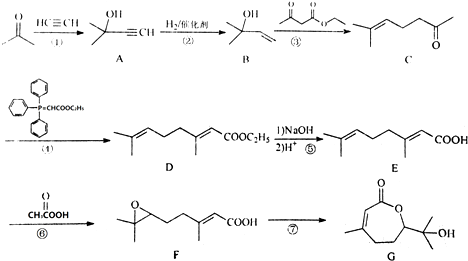
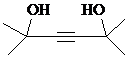 .
.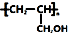 ,写出合成流程图(无机试剂任用).合成流程图示例如下:CH2=CH2$\stackrel{HBr}{→}$CH3CH2Br$→_{△}^{NaOH溶液}$CH3CH2OH.
,写出合成流程图(无机试剂任用).合成流程图示例如下:CH2=CH2$\stackrel{HBr}{→}$CH3CH2Br$→_{△}^{NaOH溶液}$CH3CH2OH.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
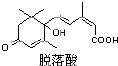 脱落酸是一种抑制生长的植物激素,因能促使叶子脱落而得名,其结构如图所示:则有关脱落酸的说法正确的是 ( )
脱落酸是一种抑制生长的植物激素,因能促使叶子脱落而得名,其结构如图所示:则有关脱落酸的说法正确的是 ( )| A. | 脱落酸的化学式C15H18O4 | |
| B. | 脱落酸只能和醇类发生酯化反应 | |
| C. | 1 mol 脱落酸最多可以和2 mol 金属钠发生反应 | |
| D. | 1 mol 脱落酸最多可以和2 mol 氢气发生加成反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 检验溴乙烷中的溴:取溴乙烷加氢氧化钠溶液,加热,再加硝酸银溶液有浅黄色沉淀生成 | |
| B. | 检验葡萄糖:在硝酸银溶液中滴加稀氨水至沉淀恰好溶解再加少许葡萄糖溶液,水浴加热 | |
| C. | 检验乙醛:加入2% 硫酸铜溶液2 mL再加入2% NaOH溶液2 mL;加热至沸腾 | |
| D. | 实验室制乙烯:取浓硫酸和乙醇体积比1:3的溶液加热到170℃ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com