
| A. | H2O2和CaF2 | B. | H2S和Na2O2 | C. | HNO3和HClO4 | D. | NH3和N2 |
科目:高中化学 来源: 题型:解答题
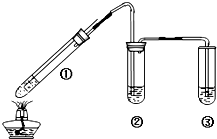 某小组用图所示实验装置(夹持仪器已略去)探究铜丝与过量浓硫酸的反应.
某小组用图所示实验装置(夹持仪器已略去)探究铜丝与过量浓硫酸的反应.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
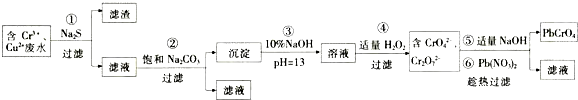
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
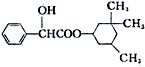 环扁桃酯具有松弛血管平滑肌、扩张血管的功能,其结构简式如图.下列对该物质的叙述中,正确的是( )
环扁桃酯具有松弛血管平滑肌、扩张血管的功能,其结构简式如图.下列对该物质的叙述中,正确的是( )| A. | 该物质属于芳香烃 | |
| B. | 该有机物不能被氧化成醛 | |
| C. | 分子式为C17H23O3 | |
| D. | 1mol该物质最多可与2 mol NaOH发生反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
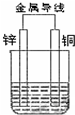
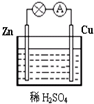 (1)Zn极为原电池的负(填“正”或“负”)极,该极的电极反应式是Zn-2e-=Zn2+,属于氧化反应(填“氧化反应”或“还原反应”).Cu极的电极反应式是2H++2e-=H2↑,
(1)Zn极为原电池的负(填“正”或“负”)极,该极的电极反应式是Zn-2e-=Zn2+,属于氧化反应(填“氧化反应”或“还原反应”).Cu极的电极反应式是2H++2e-=H2↑,查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 只有达到平衡时,消耗O2的速率与生成NO的速率之比才为5;4 | |
| B. | 若单位时间生成xmolNO的同时,消耗xmolNH3,则反应达到平衡状态 | |
| C. | 达到平衡状态后,NH3、O2、NO、H2O(g)的物质的量保持不变 | |
| D. | 达到平衡状态时,若增加容器体积,则反应速率增大 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 (1)NF3分子中N原子的杂化轨道类型为sp3,该分子的空间构型为三角锥形
(1)NF3分子中N原子的杂化轨道类型为sp3,该分子的空间构型为三角锥形查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 金属 | 电子流动方向 | 电压/V |
| Fe | Fe→Cu | +0.78 |
| Zn | Zn→Cu | +1.10 |
| A | A←Cu | -0.15 |
| B | B→Cu | +0.3 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com