
| A. | Na、Mg、Al、S的还原性依次增强 | |
| B. | O、S、Na、K的原子半径依次增大 | |
| C. | H2S、PH3、HCl、HF的热稳定性依次增强 | |
| D. | Mg(OH)2、Al(OH)3、KOH、Ca(OH)2的碱性依次增强 |
分析 A.同周期,从左向右金属性减弱;
B.电子层越多,原子半径越大;同周期原子序数大的原子半径小;
C.非金属性越强,氢化物越稳定;
D.金属性越强,对应最高价氧化物水化物的碱性越强.
解答 解:A.同周期,从左向右金属性减弱,则Na、Mg、Al、S的还原性依次减弱,故A错误;
B.电子层越多,原子半径越大;同周期原子序数大的原子半径小,则O、S、Na、K的原子半径依次增大,故B正确;
C.非金属性F>Cl>S>P,PH3、H2S、HCl、HF的热稳定性依次增强,故C错误;
D.金属性K>Ca>Mg>Al,Al(OH)3、Mg(OH)2、Ca(OH)2、KOH的碱性依次增强,故D错误;
故选B.
点评 本题考查元素周期表和周期律的综合应用,为高频考点,把握元素的位置、性质、元素周期律为解答的关键,侧重分析与应用能力的考查,题目难度不大.


科目:高中化学 来源: 题型:解答题
| 元素编号 | 元素特征信息 |
| A | 其单质是密度最小的物质 |
| B | 阴离子带两个单位负电荷,单质是空气的主要成分之一 |
| C | 其阳离子与B的阴离子有相同的电子层结构,且与B可以形成两种离子化合物 |
| D | 其氢氧化物和氧化物都有两性,与C同周期 |
| E | 与C同周期,原子半径在该周期最小 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 甲烷的比例模型: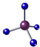 | B. | O2与O22-互为同分异构体 | ||
| C. | ${\;}_{2}^{3}$He和${\;}_{2}^{4}$He互为同素异形体 | D. | S2-的结构示意图: |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 物质 | 炭粉 | 一氧化碳 | 氢气 | 甲烷 | 乙醇 |
| 状态 | 固体 | 气体 | 气体 | 气体 | 液体 |
| 热量(kJ) | 392.8 | 282.6 | 285.8 | 890.3 | 1367 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
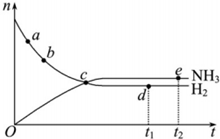 对于体积不变密闭容器中的反应:N2(g)+3H2(g)?2NH3(g),673K,30MPa下n(NH3)和n(H2)随时间变化的关系如图所示.下列叙述正确的是( )
对于体积不变密闭容器中的反应:N2(g)+3H2(g)?2NH3(g),673K,30MPa下n(NH3)和n(H2)随时间变化的关系如图所示.下列叙述正确的是( )| A. | a点、b点的正反应速率比逆反应速率大 | |
| B. | c点时每断裂3molH-H则断裂6molN-H | |
| C. | d点(t1时刻)和点e(t2时刻)处n(N2)不一样 | |
| D. | v(N2):V (NH3)=1:2时达到平衡 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
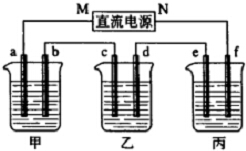 如图所示装置中,甲、乙、丙三个烧杯依次分别盛放硫酸铜溶液、饱和氯化钠溶液(滴有少许酚酞)和100g10.00%的Na2SO4溶液.
如图所示装置中,甲、乙、丙三个烧杯依次分别盛放硫酸铜溶液、饱和氯化钠溶液(滴有少许酚酞)和100g10.00%的Na2SO4溶液.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CaCl2和Na2O2 | B. | NaOH和CCl4 | C. | CO2和MgCl2 | D. | NaOH和NaClO |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com