
【题目】已知氯气的漂白作用实际上是氯气与水反应生成的次氯酸的漂白作用.为了探究SO2的漂白作用到底是SO2本身具有的还是SO2与水作用的产物具有的,某学习小组设计了如图所示的装置来进行实验.请回答相关问题. 
(1)制备SO2气体的反应方程式为: . 发生装置的玻璃仪器名称为、 .
(2)为了探究干燥的SO2能不能使品红褪色,某同学设计了如图所示实验装置,请指出实验装置设计中的不合理之处.
①;②
(3)按照修改后的装置,实验中控制SO2以大约每秒3个气泡的速度通过品红的酒精溶液时,经过一小时后,品红仍不褪色,这说明品红褪色不是SO2直接导致的.据此,SO2能使品红的水溶液褪色的可能微粒有(不考虑水及水电离出来的粒子) .
【答案】
(1)Na2S03+H2S04(浓)═Na2S04+S02↑+H20;分液漏斗;圆底烧瓶
(2)缺少二氧化硫的干燥装置;没有尾气吸收装置
(3)HSO3﹣、SO32﹣、H2SO3
【解析】解:(1)硫酸和亚硫酸钠固体制取二氧化硫发生的化学方程式是Na2S03+H2S04(浓)═Na2S04+S02↑+H20,制备装置中两种常见的玻璃仪器是分液漏斗和圆底烧瓶,
所以答案是:Na2S03+H2S04(浓)═Na2S04+S02↑+H20;分液漏斗、圆底烧瓶;(2)该实验是探究干燥的SO2能不能使品红褪色,所以二氧化硫通入品红溶液前要进行干燥,二氧化硫有毒,对环境有污染,应进行尾气处理,可选择用NaOH溶液吸收,
所以答案是:缺少二氧化硫的干燥装置;没有尾气吸收装置;(3)二氧化硫和水反应生成亚硫酸,二氧化硫和酒精不反应,二氧化硫能使品红溶液褪色而不能使品红的酒精溶液褪色,由此得出S02的漂白作用是SO2与水作用的产物导致的,二氧化硫和水反应生成亚硫酸、亚硫酸电离生成亚硫酸氢根离子、亚硫酸氢根离子电离生成亚硫酸根离子,所以使品红的水溶液褪色的微粒可能是:HSO3﹣、SO32﹣、H2SO3 , 所以答案是:HSO3﹣、SO32﹣、H2SO3;
【考点精析】利用二氧化硫的污染及治理对题目进行判断即可得到答案,需要熟知SO2是污染大气的主要有害物质之一,直接危害是引起呼吸道疾病;形成酸雨pH<5、6,破坏农作物、森林、草原、使土壤酸性增强等等;含SO2的工业废气必须经过净化处理才能排放到空气中.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】某化学兴趣设计实验制取乙酸乙酯.现用右图装置进行实验,在圆底烧瓶内加入碎瓷片,再加入由2ml98%的浓H2SO4和3mL乙醇组成的混合液,通过分液漏斗向烧瓶内加入2mL醋酸,烧杯中加入饱和Na2CO3溶液.请回答下列问题: 
(1)写出圆底烧瓶内发生反应的化学方程式为: .
(2)反应中加入浓硫酸的作用是 .
(3)球形干燥管C的作用是 .
(4)反应结束后D中的现象是:
(5)分离出D中的乙酸乙酯时需要的玻璃仪器是 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将装有60mLNO2、NO混合气的量筒倒立于水槽中,反应后气体体积缩小为40mL,则混合气体中NO2和NO的体积比是( )
A.5:3
B.2:3
C.1:1
D.2:1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A是一种来自石油的重要的有机化工原料,是衡量一个国家石油化工生产水平的标志;E是一种具有果香味的有机物,F是一种高聚物,可制成多种包装材料。(过程中的水或其他物质已省略)

(1)写出反应①的化学方程式_________________________________;反应类型____________;
(2)写出反应B+D→E的化学方程式___________________________反应类型___________;
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】研究PM 2.5、SO2、NOx等,对监测空气质量具有重要意义.取某样本用蒸馏水处理制成待测液,其中所含离子的化学组分及其浓度如下表:
离子 | K+ | Na+ | NH4+ | H+ | SO42﹣ | NO3﹣ | Cl﹣ |
浓度/molL﹣1 | 4×10﹣6 | 6×10﹣6 | 2×10﹣5 | a | 4×10﹣5 | 3×10﹣5 | 2×10﹣5 |
请回答下列问题:
(1)根据表中数据计算此待测液中c(H+)浓度a为 mol/L.
(2)NOx是汽车尾气中的主要污染物之一.
①汽车发动机工作时的高温会引发N2和O2反应,反应的化学方程式是 .
②NOx能形成酸雨,由NO2形成酸雨的主要反应是(写离子方程式).
(3)为减少SO2的排放,常采取的措施有:
①在燃煤中加入生石灰可以起到固硫的作用,SO2被吸收后转化成一种硫元素的最高价态的化合物,该物质的化学式是 .
②吸收烟气中的SO2 , 以下物质可作吸收剂的是(填序号);硫酸工业中的尾气SO2可以循环利用,写出SO2转化为SO3反应的化学方程式 .
a.NaOH b.H2SO4 c.NaHSO3 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】制备纯净的液态无水四氯化锡(SnCl4易挥发形成气体,极易发生水解,水解生成Sn02·H20)
的反应为Sn+2Cl2 ![]() SnCl4, Sn也可以与HC1反应生成SnCl2。已知:
SnCl4, Sn也可以与HC1反应生成SnCl2。已知:
物质 | 摩尔质量(g/mol) | 熔点(℃) | 沸点(℃) |
Sn | 119 | 231 | 2260 |
SnCl2 | 190 | 246 | 623 |
SnCl4 | 261 | -30 | 114 |
制备装置如图所示:
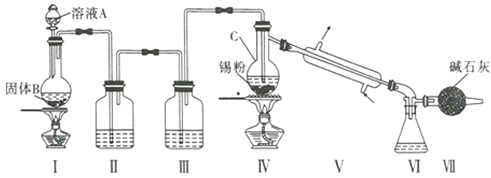
回答下列问题:
(1)Sn在元素周期表中的位罝为____________________________。
(2)II、III中的试剂分別为_______、__________;VII的作用是____________________、_____________。
(3)实验所得SnCl4因溶解了Cl2而略显黄色,提纯SnCl4的方法是____________(填序号)。
a.用NaOH溶液洗涤再蒸馏 b.升华 c.重结晶 d.蒸馏 e.过滤
(4)写出I中反应的化学方程式:_____________________________________。
(5)加热Sn粒之前要先让氯气充满整套装置,其目的是__________________________________。
(6)写出SnCl4水解的化学方程式:________________________________________。
(7)若IV中用去锡粉5.95g,反应后,VI中锥形瓶里收集到12.0gSnCl4,则SnCl4的产率为_____%。(保留一位小数)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com