
| A. | 1个 | B. | 2个 | C. | 3个 | D. | 5个 |
分析 ①汽油中不含氮元素;
②干冰升华和碘化银易分解过程都吸收热量;
③根据单质之间的置换反应可以确定还原性的强弱;
④氟利昂破坏臭氧层,导致臭氧空洞;
⑤次氯酸钙具有强氧化性,能杀菌消毒,且具有漂白性;
解答 解:①汽油中不含氮元素,汽车尾气中的氮氧化物是空气中的氮气与氧气在高温下生成的,故错误;
②干冰升华和碘化银易分解过程都吸收热量,从而使空气中的水蒸气变小液滴,故正确;
③工业上,焦炭在高温下还原二氧化硅得到粗硅和一氧化碳,根据元素周期律知识,还原性C<Si,故错误;
④氟利昂破坏臭氧层,导致臭氧空洞,而温室效应与二氧化碳的排放有关,故错误;
⑤次氯酸钙具有强氧化性,能使蛋白质变性而杀菌消毒,同时也具有漂白性,所以漂白粉既可做漂白棉麻纸张的漂白剂,又可做游泳池及环境的消毒剂,故正确;
故选:C.
点评 本题化学在生产生活中的应用,熟悉相关物质的性质是解题关键,题目难度不大,注意对知识的积累.


 优加精卷系列答案
优加精卷系列答案科目:高中化学 来源: 题型:填空题

查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 (1)具有复合官能团的复杂有机物中官能团具有各自的独立性,在不同条件下所发生的化学反应可分别从各官能团讨论.如图;具有两种官能团:
(1)具有复合官能团的复杂有机物中官能团具有各自的独立性,在不同条件下所发生的化学反应可分别从各官能团讨论.如图;具有两种官能团: 和
和 (填化学式),所以这个化合物看作羧酸类和醛类.
(填化学式),所以这个化合物看作羧酸类和醛类. ,此烃的名称为3-甲基-2-乙基-1-戊烯
,此烃的名称为3-甲基-2-乙基-1-戊烯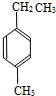 ,此烃名称为对甲基乙苯或4-甲基乙基苯
,此烃名称为对甲基乙苯或4-甲基乙基苯 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
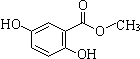
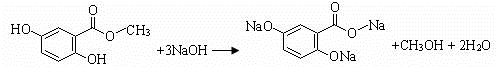 .(不用写反应条件)
.(不用写反应条件)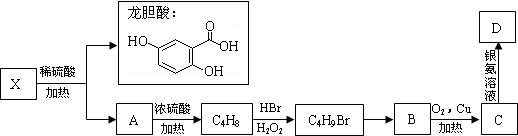
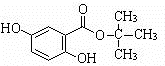 .
.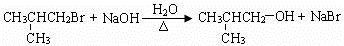 .(用结构简式表示)
.(用结构简式表示)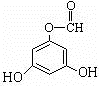 或
或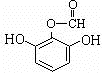 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
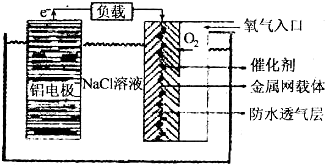
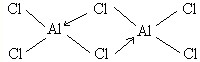 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 4 mol A+2 mol B | B. | 3 mol C+1 mol D+2mol A+1 mol B | ||
| C. | 3mol C+1 mol D+1 mol B | D. | 3 mol C+1 mol D |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题

| A. | a和d互为同素异形体 | B. | b和c互为同系物 | ||
| C. | a和d都能发生加成反应 | D. | 只有b和c能发生取代反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com