
| A. | 室温下,pH>7的醋酸和醋酸钠的混合溶液中:c(CH3COO-)>c(Na+) | |
| B. | 将醋酸钠、盐酸两溶液混合后,溶液呈中性,则混合后的溶液中:c(Na+)=c(Cl-) | |
| C. | 等pH的氨水、KOH溶液、Ba(OH)2溶液中:c(NH${\;}_{4}^{+}$)=c(K+)=c(Ba2+) | |
| D. | 0.2mol•L-1某一元弱酸HA溶液和0.1mol•L-1NaOH溶液等体积混合后的溶液:2c(OH-)+c(A-)=2c(H+)+c(HA) |
分析 A.室温下,pH>7的醋酸和醋酸钠的混合溶液中,c(H+)<c(OH-),溶液中电荷守恒分析判断;
B.根据溶液中的电荷守恒来分析;
C.KOH溶液、Ba(OH)2溶液为强碱溶液,氨水是弱碱溶液存在电离平衡,PH相同说明溶液中氢氧根离子浓度相同,据此分析;
D.0.2mol•L-1某一元弱酸HA溶液和0.1mol•L-1NaOH溶液等体积混合后的溶液得等浓度的NaA和HA混合溶液,依据溶液中电荷守恒和物料守恒分析.
解答 解:A.室温下,pH>7的醋酸和醋酸钠的混合溶液中,c(H+)<c(OH-),溶液中存在电荷守恒,c(Na+)+c(H+)=c(CH3COO-)+c(OH-):c(CH3COO-)<c(Na+),故A错误;
B.溶液呈中性,反应后有c(OH-)=c(H+),根据c(Na+)+c(H+)=c(CH3COO-)+c(OH-)+c(Cl-),可知c(Na+)=c(CH3COO-)+c(Cl-),故B错误;
C.等pH的氨水、KOH溶液、Ba(OH)2溶液中,KOH溶液、Ba(OH)2溶液为强碱溶液,氨水是弱碱溶液,c(NH4+)=c(K+)>c(Ba2+),故C错误;
D.0.2mol•L-1某一元弱酸HA溶液和0.1mol•L-1NaOH溶液等体积混合后的溶液得等浓度的NaA和HA混合溶液,电荷守恒c(Na+)+c(H+)=c(A-)+c(OH-),物料守恒:2c(Na+)=c(A-)+c(HA),计算得到2c(OH-)+c(A-)=2c(H+)+c(HA),故D正确;
故选D.
点评 本题主要考查了酸碱反应后溶液酸碱性判断、电荷守恒、盐类水解、离子共存的判断,难度中等,注意知识的积累.


 开心蛙口算题卡系列答案
开心蛙口算题卡系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CH2=CH2+HBr→CH3CH2Br | |
| B. | CH3CH3+C12$\stackrel{光照}{→}$CH3CH2+Cl+HCl | |
| C. | 2CH3CH2OH+02$→_{△}^{Cu}$2CH3CHO+2H20 | |
| D. | CH3COOH+CH3CH2OH$?_{△}^{浓硫酸}$CH3COOCH2CH3+H20 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 金属腐蚀就是金属失去电子被还原的过程 | |
| B. | 热的纯碱溶液去油污效果更好 | |
| C. | 包装用材料聚氯乙烯属于烯烃 | |
| D. | PX项目中的对二甲苯属于脂肪烃 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | C3H8与C5H12 | B. | C3H6与C5H10 | ||
| C. | CH4O与C2H6O | D. | C6H5OH与C6H5CH2OH |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NaH与重水反应的方程式:NaH+D2O═NaOH+D2↑ | |
| B. | 三氟化氮的电子式: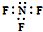 | |
| C. | 熔融状态下硫酸氢钠的电离方程式:NaHSO4(熔融)═Na++HSO4- | |
| D. | 硫化钠溶液显碱性的原因:S2-+H2O?H2S+2OH- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
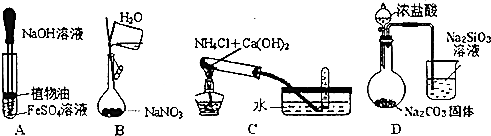
| A. | 观察Fe(OH)2的生成 | |
| B. | 配置1mol•L-1的NaNO3溶液 | |
| C. | 实验室制取氨气 | |
| D. | 比较HCl、H2CO3和H2SiO3的酸性强弱 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
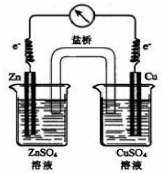
| A. | 该装置可以将化学能转变为电能 | B. | 电子由锌电极向铜电极移动 | ||
| C. | 盐桥中的阴离子向锌电极移动 | D. | 锌电极为正极,发生氧化反应 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com