
【题目】参考如图和有关要求回答问题: 
(1)甲醇质子交换膜燃料电池中将甲醇蒸气转化为氢气的一种原理是CH3OH(g)和H2O(g)反应生成CO2和H2 . 图1是该过程中能量变化示意图,若在反应体系中加入催化剂,反应速率增大,正反应活化能 a的变化是(填“增大”、“减小”、“不变”),反应热△H的变化是(填“增大”、“减小”、“不变”).
(2)以CH3OH燃料电池为电源电解法制取ClO2 . 二氧化氯(ClO2)为一种黄绿色气体,是国际上公认的高效、广谱、快速、安全的杀菌消毒剂. ①CH3OH燃料电池放电过程中,通入O2的电极附近溶液的pH(填“增大”、“减小”、“不变”).负极反应式为 .
②图2中电解池用石墨作电极,在一定条件下电解饱和食盐水制取 ClO2 . 阳极产生 ClO2的反应式为 .
③电解一段时间,从阴极处收集到的气体比阳极处收集到气体多 6.72L时(标准状况,忽略生成的气体溶解),停止电解,通过阳离子交换膜的阳离子为mol.
(3)图2中电解池改为用石墨作电极,在一定条件下电解0.05molL﹣1的硫酸铜溶液200mL,当两极产生的气体体积相同时, ①发生电解的总反应方程式为
②若电解后溶液的体积还是200mL,溶液的pH=
③电解后加入下列固体物质可使溶液恢复到电解前
A CuO B Cu (OH)2C CuCO3D CuSO4 .
【答案】
(1)减小;不变
(2)增大;CH3OH﹣6e﹣+8OH﹣=CO32﹣+6H2O;Cl﹣﹣5e﹣+2H2O=4H++ClO2↑;1
(3)2CuSO4+2H2O ![]() 2Cu+2H2SO4+O2↑;1;B
2Cu+2H2SO4+O2↑;1;B
【解析】解:(1)催化剂降低反应的活化能,加快反应速率,即a减小,但催化剂不能改变活化能,即反应热△H不变,反应能量图中生成物的总能量大于反应物的总能量,则为吸热反应,由图可知,1mol 甲醇和1mol 水蒸气反应生成CO2和氢气吸收的热量为(a﹣b)kJ,反应热化学方程式为:CH3OH(g)+H2O(g)=CO2(g)+3H2(g)△H=+(a﹣b)kJ/mol, 所以答案是:减小;不变;CH3OH(g)+H2O(g)=CO2(g)+3H2(g)△H=+(a﹣b)kJ/mol;(2)①CH3OH燃料电池放电过程中,通入O2的电极是正极,氧气得到电子转化为氢氧根,则附近溶液的pH增大,
所以答案是:增大;
②电解池中阳极失去电子,则阳极氯离子放电,产生ClO2的反应式为:Cl﹣﹣5e﹣+2H2O=4H++ClO2↑,
所以答案是:Cl﹣﹣5e﹣+2H2O=4H++ClO2↑;
③电解一段时间,从阴极处收集到的气体比阳极处收集到气体多 6.72L时(标准状况,忽略生成的气体溶解),多出的气体是氢气,物质的量= ![]() =0.3mol,设阳极产生的气体是xmol,则根据电子得失守恒可知5x=(0.3+x)×2,解得x=0.2,即转移1mol电子,钠离子通过阳离子交换膜,所以通过阳离子交换膜的阳离子为1mol,
=0.3mol,设阳极产生的气体是xmol,则根据电子得失守恒可知5x=(0.3+x)×2,解得x=0.2,即转移1mol电子,钠离子通过阳离子交换膜,所以通过阳离子交换膜的阳离子为1mol,
所以答案是:1;(3)①电解总反应式为2CuSO4+2H2O ![]() 2Cu+2H2SO4+O2↑,所以答案是:2CuSO4+2H2O
2Cu+2H2SO4+O2↑,所以答案是:2CuSO4+2H2O ![]() 2Cu+2H2SO4+O2↑;
2Cu+2H2SO4+O2↑;
②电解硫酸铜溶液0.01mol,阴极上发生反应:Cu2++2e﹣═Cu,2H++2e﹣═H2↑,0.01mol铜离子得电子转移0.02mol电子,若产生224mL即0.01mol气体,转移电子是0.022mol,共0.04mol电子转移,阳极上发生反应4OH﹣﹣4e﹣═2H2O+O2↑,产生相同气体,若为224mL即0.01mol气体,转移电子的物质的量是0.04mol,根据反应式:2CuSO4+2H2O ![]() 2Cu+2H2SO4+O2↑,当生成0.01mol铜,生成硫酸是0.01mol,所以氢离子浓度是
2Cu+2H2SO4+O2↑,当生成0.01mol铜,生成硫酸是0.01mol,所以氢离子浓度是 ![]() =0.1mol/L,所以pH=1;所以答案是:1;
=0.1mol/L,所以pH=1;所以答案是:1;
③电解过程中少什么加什么,少多少加多少,根反应式:阴极上发生反应:Cu2++2e﹣═Cu,2H++2e﹣═H2↑,阳极上发生反应4OH﹣﹣4e﹣═2H2O+O2↑,析出了铜,跑掉了氧气和氢气,故选B.
【考点精析】掌握反应热和焓变是解答本题的根本,需要知道在化学反应中放出或吸收的热量,通常叫反应热.


科目:高中化学 来源: 题型:
【题目】净水剂能够改善水质,给人们的生活、健康带来很大的益处。
(1) 明矾[KAl(SO4)2·12H2O]是常见的净水剂。其在水中的电离方程式为_______;明矾可净水是因为在天然水中生成胶状Al(OH)3,Al(OH)3具有____的作用。
(2)碱式氯化铝(简称BAC)是高效净水剂的主要成分。实验室模拟利用铝土矿(主要含Al2O3,还含少量Fe2O3及其他不溶杂质)制取碱式氯化铝[Al2(OH)nCl6-n]的过程如下:

①盐酸溶解铝土矿过程中,发生反应的离子方程式为_____________、_______;溶解过程中需不断搅拌,目的是________________。
②加适量铝粉的主要作用是_______________。
③蒸发浓缩所需玻璃仪器为_______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】SO2和NOx是主要的大气污染物。某小组认为一定条件下,用NH3与NO2反应转化为无污染物质可进行汽车尾气无害化处理。
(1)氨气的制备
①实验室制氨气的化学方程式为_________。
②制备和收集纯净、干燥的氨气,可以选择下图装置______(填序号),C中试剂为______。

(2)氨气与二氧化氮的反应(已知:2NO2+2NaOH=NaNO3+NaNO2+H2O。)
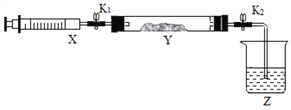
①在硬质玻璃管Y中加入少量催化剂,将NO2气体注入Y管中,Z中应盛装______。
②打开K1,将注射器X中的NH3缓慢注入Y中,发生反应的方程式为_______。
③将注射器活塞退回原处并固定,待装置恢复到室温,打开K2,Y中出现倒吸现象,原因是_________。
(3)该小组进一步研究SO2的性质,探究SO2能否与Na2O2发生氧化还原反应。实验室用铜丝和浓硫酸反应生成SO2的化学方程式为____________。利用(2)中装置,将Y中的药品更换为少量Na2O2,将注射器X中SO2缓慢推入Y中,Y装置中淡黄色粉末变成白色。设计方案检验生成的白色物质中含有SO42-_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,下列无色溶液中一定能大量共存的离子组是
A. K+、Cu 2+、NO3-、SO42- B. K+、H+、I-、MnO4-
C. Mg2+、Na+、SO42-、OH- D. Na+、NH4+、Cl-、NO3-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】电子工业常用30%的FeCl3溶液腐蚀敷在绝缘板上的铜箔,制造印刷电路板。
(1)检验溶液中Fe3+存在的试剂是________,证明Fe3+存在的现象是________。
(2)写出FeCl3溶液与金属铜发生反应的离子方程式:________。
(3)某工程师为了从使用过的腐蚀废液中回收铜,并重新获得纯净的FeCl3溶液,准备采用下列步骤:

请写出上述实验中加入或生成的有关物质的化学式。
①________,④________。
(4)要证明某溶液中不含Fe3+而可能含有Fe2+,进行如下实验操作时的最佳顺序为________。
①加入足量氯水②加入足量KMnO4溶液③加入少量KSCN溶液
A.①③ B.③② C.③① D.①②③
(5)写出向②⑤的混合液中通入⑥的离子方程式:________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com