
20℃时,饱和KCl溶液的密度为1.174g·cm-3,物质的量浓度为4.0mol·L-1,则下列说法中不正确的是
A.20℃时,饱和KCl溶液与等质量的水混合后物质的量浓度大于2.0mol·L-1
B.20℃时,将29.8gKCl溶于87.6g水中可得饱和溶液
C.20℃时,密度小于1.174g·cm-3的KCl溶液是不饱和溶液
D.将此溶液蒸发部分水,再恢复到20℃时,溶液中各离子的浓度不变
科目:高中化学 来源:2016-2017学年广东省高二上期中化学卷(解析版) 题型:选择题
下列说法不正确的是( )
A.油脂会造成人体肥胖,所以不能食用
B.脂肪酸在体内可以被氧化从而供给人体热量
C.摄入人体的脂肪大部分成为脂肪组织存在于人体内
D.必需脂肪酸在体内有促进发育、维持健康和参与胆固醇代谢的生理功能
查看答案和解析>>
科目:高中化学 来源:2017届贵州省高三上半期考试化学试卷(解析版) 题型:选择题
工业上,可用硫酸铈[Ce(SO4)2]溶液吸收尾气中NO,其化学方程式如下:2NO+3H2O+4Ce(SO4)2=2Ce2(SO4)3+HNO3+HNO2+2H2SO4
下列说法正确的是( )
A.在该反应中氧化剂与还原剂的物质的量之比为1∶2
B.在该反应中,氧化产物有两种,还原产物有一种
C.若不考虑溶液体积变化,吸收尾气后,溶液的pH将增大
D.在该反应中,每消耗22.4LNO必转移2 mol电子
查看答案和解析>>
科目:高中化学 来源:2017届甘肃省高三上第二阶段考化学试卷(解析版) 题型:选择题
下列表示对应化学反应的离子方程式正确的是
A.向Al2(SO4)3溶液中加入过量NH3·H2O:Al3++4NH3·H2O===[Al(OH )4]-+4NH
)4]-+4NH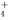
B. 铅酸蓄电池充电时的正极反应:PbO2+4H++SO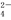 +2e-===PbSO4+2H2O
+2e-===PbSO4+2H2O
C.Fe2(SO4)3溶液与Ba(OH)2溶液反应:Fe3++SO42-+Ba2++3OH-===Fe(OH)3 ↓ + BaSO4↓
D.(NH4)2Fe(SO4)2溶液与过量NaOH溶液反应:2NH4++Fe2++4OH-===Fe(OH)2↓+2NH3·H2O
查看答案和解析>>
科目:高中化学 来源:2017届安徽省高三上学期期中化学试卷(解析版) 题型:实验题
氯气在工业上有着重要的用途,某兴趣小组在实验室中模拟工业上用氯气制备无水氯化铝(无水AlCl3(183℃升华)遇潮湿空气即产生大量白雾)。可用下列装置制备。


(1)装置B中盛放 溶液,其作用是 。F中的是 溶液,其作用是 。用一件仪器装填适当试剂后也可起到F和G的作用,所装填的试剂为 。
(2)装置A实验开始时,先检查装置气密性,接下来的操作依次是 (填序号)。
A.往烧瓶中加入MnO2粉末 B.加热 C.往烧瓶中加入浓盐酸
(3)制备反应会因盐酸浓度下降而停止。为测定反应残余液中盐酸的浓度,探究小组同学提出很多实验方案,其中方案之一为让残留的液体与足量Zn反应,测量生成的H2体积。装置如右图所示(夹持器具已略去)。
①使Y形管中的残余清液与锌粒反应的正确操作是将 转移到 中。
②反应完毕,每间隔1分钟读取气体体积、气体体积逐渐减小,直至不变。气体体积逐次减小的原因是 (排除仪器和实验操作的影响因素)。
(4)该小组同学查资料得知:将氯酸钾固体和浓盐酸混合也能生成氯气,同时有大量ClO2生成;ClO2沸点为10℃,熔点为-59℃,液体为红色;Cl2沸点为-34℃,液态为黄绿色。设计最简单的实验验证Cl2中含有ClO2 _____________________。
查看答案和解析>>
科目:高中化学 来源:2017届安徽省高三上学期期中化学试卷(解析版) 题型:选择题
白磷有剧毒,白磷中毒可用硫酸铜溶液解毒,白磷与硫酸铜可以发生如下两个反应:
(1)2P+5CuSO4+8H2O 5Cu+2H3P
5Cu+2H3P O4+5H2SO4
O4+5H2SO4
(2)11P+15CuSO4+24H2O 5Cu3P+6H3PO4+15H2SO4
5Cu3P+6H3PO4+15H2SO4
下列有关说法中错误的是
A.上述两个反应中,水既不是氧化剂也不是还原剂
B.上述两个反应中,氧化产物都是H3PO4
C.反应(2)中,1molCuSO4可氧化1/5molP
D.上述两个反应中,氧化剂都只有硫酸铜
查看答案和解析>>
科目:高中化学 来源:2017届山东省高三上第一次质检化学试卷(解析版) 题型:实验题
亚硝酸钠是重要的防腐剂。某化学兴趣小组以碳和浓硝酸为起始原料,设计如下装置利用一氧化氮与过氧化钠反应制备亚硝酸钠。 (夹持装置和A中加热装置已略,气密性已检验)。
查阅资料:①HNO2为弱酸,室温下存在反应3HNO2==HNO 3+2NO↑+H2O;
3+2NO↑+H2O;
②在酸性溶液中,NO2-可将MnO4-还原为Mn2+。
③NO不与碱反应,可被酸性KMnO4溶液氧化为硝酸
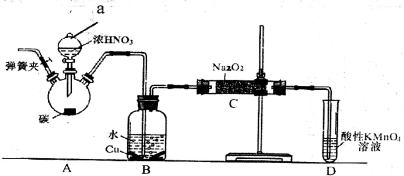
实验操作:①关闭弹簧夹,打开A中分液漏斗活塞,滴加一定量浓硝酸,加热;
②一段时间后停止加热;
③从C中取少量固体,检验是否是亚硝酸钠。
回答下列问题:
(1)装置中仪器a的名称为___________;D装置的作用是_______________。
(2)A中反应的化学方程式是___________________,C中反应生成NaNO2的化学方程式是____________。
(3)检验C中产物有亚硝酸钠的正确操作是__________
a.取少量生成物溶于水充分振荡,滴加酚酞试液,若溶液变红,则含有NaNO2。
b.取少量生成物溶于稀硫酸,若产生无色气体并在液体上方变为红 棕色,则含有NaNO2。
棕色,则含有NaNO2。
(4)经检验C产物中亚硝酸钠含量较少。
①甲同学认为C中产物不仅有亚硝酸钠,还可能有其它固体物质。为排除干扰,甲在B、C装置间增加装置E,E中盛放的试剂应是________(写名称).
②乙同学认为除上述干扰因素外,还会有空气参与反应导致产品不纯,所以在实验操作①前应增加一步操作,该操作是______________。
(5)NaNO2有毒,国家规定肉制品中NaNO2含量不能超过30mg/kg。从1000g隔夜熟肉, 中提取NaNO3和NaNO2后,配成溶液,再用0.00500mol/L的高锰酸钾(酸性)溶液滴定,消耗高锰酸钾溶液16.00mL,由此计算隔夜熟肉中NaNO2的含量是________mg/kg 。
查看答案和解析>>
科目:高中化学 来源:2017届山东省高三上第一次质检化学试卷(解析版) 题型:选择题
下列有关化学基本概念的判别正确的是:( )
A.氧化还原反应的本质是元素化合价的升降
B.分散系分为溶液、胶体和浊液的依据:分散质微粒直径大小
C.某元素由化合态变为游离态,此元素一定被还原
D.强电解质与弱电解质:溶液的导电能力大小
查看答案和解析>>
科目:高中化学 来源:2017届湖北省高三上第四次质检化学试卷(解析版) 题型:选择题
室温下,将1mol的CuSO4•5H2O(s)溶于水会使溶液温度降低,热效应为△H1,将1mol的CuSO4(s)溶于水会使溶液温度升高,热效应为△H2:CuSO4•5H2O受热分解的化学方程式为CuSO4•5H2O(s)  CuSO4(s)+5H2O(l),热效应为△H3,则下列判断正确的是( )
CuSO4(s)+5H2O(l),热效应为△H3,则下列判断正确的是( )
A.△H2>△H3 B.△H1<△H3
C.△H1+△H3=△H2 D. △H1+△H2>△H3
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com