
 铁、铝是应用最广泛的两种金属.完成下列填空:
铁、铝是应用最广泛的两种金属.完成下列填空:分析 (1)质子数相同中子数不同的同种元素的不同原子互称为同位素,原子中质子数+中子数=质量数;
(2)常温下铁、铝金属在浓硫酸、浓硝酸中发生钝化;
(3)铝和氧化铁混合粉末为铝热剂,引发反应后放出大量的热量,可以熔融金属;
(4)铝和强碱溶液发生反应,铁和强碱溶液不反应;
(5)向某溶液中投入铝片后有大量H2放出,溶液为酸或强碱溶液,离子之间不能结合生成水、气体等,则离子能大量共存,以此来解答;
(6)在3Fe+8HNO3(稀)=3Fe(NO3)2+2NO↑+4H2O反应中,Fe元素化合价由0价升高到+2价,被氧化,为还原剂,N元素化合价由+5价降低到+2价,被还原,HNO3为氧化剂,以此解答.
解答 解:(1)存在四种稳定的铁原子,分别是54Fe、56Fe、57Fe和58Fe,质子数相同,中子数不同它们互称为同位素,中子数=质量数-质子数=58-26=32,中子数与质子数之差为32-26=6
故答案为:同位素,6;
(2)工业上可用铁槽车运输浓硫酸,是由于常温下浓硫酸能使铁钝化,在铁表面形成一薄层致密氧化物薄膜阻止反应进行,表现了浓硫酸的强氧化性,
故答案为:钝化;
(3)铝和氧化铁混合粉末反应得到的液态铁,发生的是铝热反应,引发剂作用下发生氧化还原反应,放出大量热,可以使生成的铁呈熔融状态,用来焊接钢轨,反应的化学方程式为:2Al+Fe2O3$\frac{\underline{\;高温\;}}{\;}$Al2O3+2Fe,
故答案为:2Al+Fe2O3$\frac{\underline{\;高温\;}}{\;}$Al2O3+2Fe,放热;
(4)铁粉中混有少量的铝粉,铝和强碱溶液发生反应,铁和强碱溶液不反应,除去方法是放入氢氧化钠溶液中充分反应后过滤得到铁,铝和氢氧化钠溶液反应生成偏铝酸钠溶液和氢气,2Al+2NaOH+2H2O=2NaAlO2+3H2↑,
故答案为:加入NaOH,然后过滤;
(5)向某溶液中投入铝片后有大量H2放出,溶液为酸或强碱溶液,
a.Cl-不与酸或碱反应,一定能大量存在,故a不选;
b.H+在酸溶液中能大量存在,故b不选;
c.OH-在碱溶液中能大量存在,故c不选;
d.HCO3-既能与酸反应又能与碱反应,则一定不能大量共存,故d选;
故选d.
故答案为:d;
(6)3Fe+8HNO3→3Fe(NO3)2+2NO↑+4H2O,N元素的化合价降低,则HNO3为氧化剂,还原产物为NO,Fe元素化合价0价变化为+2价,化合价升高失电子做还原剂被氧化得到氧化产物Fe(NO3)2 ,标准状况下,每生成2molNO电子转移总数为6mol,每转移1.8mol电子,生成NO物质的量0.6mol,标准状况下的体积=22.4L/mol×0.6mol=13.44L,
故答案为:HNO3,Fe(NO3)2,13.44.
点评 本题考查了铁及其化合物性质,主要是物质提纯,铝热反应,离子共存,氧化还原反应等知识的综合应用,掌握基础是关键,题目难度中等.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
| A. | Cl2通入水中:Cl2+H2O═2H++Cl-+ClO- | |
| B. | 用FeCl3溶液腐蚀印刷电路板:Fe3++Cu═Fe2++Cu2+ | |
| C. | 钠加入水中:Na+H2O═Na++OH-+H2↑ | |
| D. | 铜片放入浓HNO3溶液中:Cu+4H++2NO3-═Cu2++2NO2↑+2H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
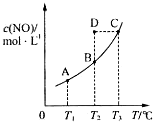 在容积一定的密闭容器中,置入一定量的一氧化氮和足量碳发生化学反应:C (s)+2NO(g)?CO2(g)+N2(g),平衡时c (NO)与温度T的关系如图所示,则下列说法正确的是( )
在容积一定的密闭容器中,置入一定量的一氧化氮和足量碳发生化学反应:C (s)+2NO(g)?CO2(g)+N2(g),平衡时c (NO)与温度T的关系如图所示,则下列说法正确的是( )| A. | 该反应的△H>0 | |
| B. | 若该反应在T1、T2时的平衡常数分别为K1、K2,则K1<K2 | |
| C. | 在T2时,若反应体系处于状态D,则此时v正>v逆 | |
| D. | 若状态B、C、D的压强分别为PB、PC 、PD ,则 PC=PD>PB |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 摩尔质量:g/mol | B. | 气体摩尔体积:mol/L | ||
| C. | 溶解度:g/100gH2O | D. | 密度:g/cm3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Cl2和澄清石灰水反应:Cl2+2OH-═Cl-+ClO-+H2O | |
| B. | NaHCO3溶液与NaOH溶液反应:OH-+HCO3-═CO2↑+H2O | |
| C. | 向AlCl3溶液中加入过量的氨水:Al3++3OH-═Al(OH)3↓ | |
| D. | 实验室用大理石和稀醋酸制取CO2:CaCO3+2H+═Ca2++CO2↑+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com