
【题目】常压下羰基化法精炼镍的原理为:Ni(s)+4CO(g)![]() Ni(CO)4(g) △H<0 230℃时,该反应的平衡常数K=2×10-5。已知:Ni(CO)4的沸点为42.2℃,固体杂质不参与反应。第一阶段:将粗镍与CO反应转化成气态Ni(CO)4;
Ni(CO)4(g) △H<0 230℃时,该反应的平衡常数K=2×10-5。已知:Ni(CO)4的沸点为42.2℃,固体杂质不参与反应。第一阶段:将粗镍与CO反应转化成气态Ni(CO)4;
第二阶段:将第一阶段反应后的气体分离出来,加热至230℃制得高纯镍,
下列判断错误的是
A. 第一阶段,选择反应温度应髙于42.2℃
B. 第一阶段增加c(CO),平衡向正向移动,反应的平衡常数不变
C. 第二阶段,Ni(CO)4几乎完全分解
D. 第二阶段,及时分离出Ni,有利于平衡移动
科目:高中化学 来源: 题型:
【题目】下表列出了①~⑩十种元素在周期表中的位置。
族 周期 | ⅠA | 0 | ||||||
1 | ① | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | |
2 | ② | ④ | ⑩ | |||||
3 | ⑤ | ⑥ | ⑦ | ③ | ⑧ | ⑨ | ||
回答下列问题:
(1)①、④按原子个数比1:1 组成的分子的电子式为____________________ ;由②、④两种元素组成的一种无毒化合物的结构式为 _____________________。
(2)这10种元素中,化学性质最不活泼的元素是_____________(填元素符号,下同),得电子能力最强的原子是__________________,失电子能力最强的单质与水反应的化学方程式是_________________________。
(3)用化学方程式表示②和⑨两种元素的非金属性强弱:________________________ 。
(4)元素③的气态氢化物和元素⑧的气态氢化物中,易于制备的是 ____________________(填化学式)
(5)元素⑤的最高价氧化物对应的水化物与元素⑦的最高价氧化物对应的水化物反应,其离子方程式为 ______________________________。
(6)元素 ①、④、⑤两两之间可以形成两种类型的化合物,写出一种共价化合物的化学式:___________________ ;写出一种离子化合物的化学式:______________________。
(7)写出⑥的单质置换出②的单质的化学方程式:________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下可逆反应:A(s)+2B(g)![]() 2C(g)+D(g) △H<0。现将1 mol A和2 mol B加入甲容器中,将4 mol C和2 mol D加入乙容器中,此时控制活塞P,使乙的容积为甲的2倍,t1时两容器内均达到平衡状态(如图1所示,隔板K不能移动)。下列说法正确的是
2C(g)+D(g) △H<0。现将1 mol A和2 mol B加入甲容器中,将4 mol C和2 mol D加入乙容器中,此时控制活塞P,使乙的容积为甲的2倍,t1时两容器内均达到平衡状态(如图1所示,隔板K不能移动)。下列说法正确的是

A. 保持活塞位置不变,升高温度,达到新的平衡后,甲、乙中B的体积分数均减小
B. 保持温度和活塞位置不变,在甲中再加入1 mol A和2 mol B,达到新的平衡后,甲中C的浓度是乙中C的浓度的2倍
C. 保持温度和乙中的压强不变,t2时分别向甲、乙中加入等质量的氦气后,甲、乙中反应速率变化情况分别如图2和图3所示(t1前的反应速率变化已省略)
D. 保持温度不变,活塞P可自由移动,达到新的平衡后,乙中C的浓度和甲中C的浓度相等
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】关节炎首次发作一般在寒冷季节,原因是关节滑液中形成了尿酸钠晶体(NaUr),易诱发关节疼痛,其化学机理是:①HUr(aq)+H2O(1)![]() Ur-(aq)+H3O+(aq)
Ur-(aq)+H3O+(aq)
② Ur-(aq)+Na+(aq)![]() NaUr(s) △H
NaUr(s) △H
下列叙述错误的是
A. 降低温度,反应②平衡正向移动
B. 反应②正方向是吸热反应
C. 降低关节滑液中HUr及Na+含量是治疗方法之一
D. 关节保暖可以缓解疼痛,原理是平衡②逆向移动
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知苯与一卤代烷在催化剂作用下可生成苯的同系物:![]() +CH3X→
+CH3X→![]() +HX,在催化剂存在下,由苯和下列各组物质合成乙苯最好应选用的是
+HX,在催化剂存在下,由苯和下列各组物质合成乙苯最好应选用的是
A.CH2=CH2和HClB.CH3CH3和I2
C.CH2=CH2和Cl2D.CH3CH3和HCl
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】生产钡盐的主要原料是重晶石(BaSO4)。在高温下,重晶石与石墨存在如下反应:
①: BaSO4(s)+4C(s,石墨) ![]() 4CO(g)+BaS(s) ΔH1=+571.2 kJ/mol
4CO(g)+BaS(s) ΔH1=+571.2 kJ/mol
②: BaSO4(s)+4CO(g) ![]() 4CO2(g)+BaS(s) ΔH2 =-118.8 kJ/mol
4CO2(g)+BaS(s) ΔH2 =-118.8 kJ/mol
回答下列问题:
(1)反应①在一定条件下能够自发的原因:_______________;
(2)已知:C(s,石墨)+O2(g) = CO2(g) ΔH3 =-393.5 kJ/mol;
求 CO 的标准燃烧热ΔH4 = _______kJ/mol;
(3)图 1 为 1200K下, 恒容密闭容器中重晶石与石墨反应时, c(CO)随时间变化曲线图。 请分析图 1 曲线 c(CO)在 0-t2 区间变化的原因:_________________;
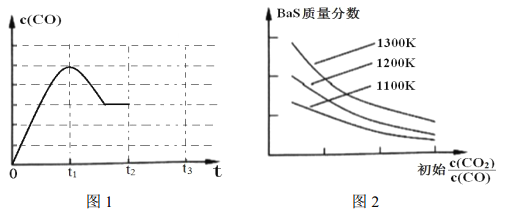
(4)图2为实验测得不同温度下, 反应体系中初始浓度比![]() 与固体中BaS质量分数的关系曲线。 分析图2 曲线, 下列说法正确的有________;
与固体中BaS质量分数的关系曲线。 分析图2 曲线, 下列说法正确的有________;
A.提高 BaSO4 的投料量,可提高 BaS 的产率
B.恒温恒容时, 当混合气体的密度不变, 反应①、②均达到化学平衡状态
C.减小初始浓度比![]() ,有利于增大 BaSO4 的转化率
,有利于增大 BaSO4 的转化率
D.适当升高温度,反应②的平衡左移,对生成 BaS不利
(5)图1 中, t2 时刻将容器体积减小为一半, t3 时刻达到新的平衡, 请在图 1 中画出 t2-t3 区间 c(CO)的变化曲线。________________
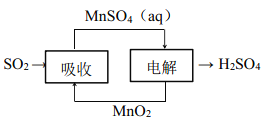
(6)工业生产中产生的 SO2 废气可用如图方法获得H2SO4。写出电解的阳极反应式_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为确定某盐A(仅含三种元素)的组成,某研究小组按如图流程进行了探究:

请回答:
(1)A的化学式为______________________。
(2)固体C与稀盐酸反应的离子方程式是________________________。
(3)A加热条件下分解的化学方程式为________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】我国古代青铜器工艺精湛,有很高的艺术价值和历史价值,但出土的青铜器易受到环境腐蚀,所以对其进行修复和防护具有重要意义。
(1)采用“局部封闭法”可以防止青铜器进一步被腐蚀。如将糊状Ag2O涂在被腐蚀部位,Ag2O与有害组分CuCl发生复分解反应,该化学方程式为_________________________________________________。
(2)下图为青铜器在潮湿环境中发生的电化学腐蚀的示意图。

①腐蚀过程中,负极是_____(填“a”“b”或“c”);
②环境中的Cl-扩散到孔口,并与正极反应产物和负极反应产物作用生成多孔铜锈Cu2(OH)3Cl,其离子方程式为_______________;
③若生成4.29 g Cu2(OH)3Cl,则理论上耗氧体积为______L(标准状况)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如下图所示,铁有δ、γ、α三种同素异形体,三种晶体在不同温度下能发生转化。下列说法正确的是 ( )

A. γ-Fe晶体中与每个铁原子距离相等且最近的铁原子有6个
B. α-Fe晶体中与每个铁原子距离相等且最近的铁原子有6个
C. 将铁加热到1 500 ℃分别急速冷却和缓慢冷却,得到的晶体类型相同
D. 三种同素异形体的性质相同
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com