
【题目】在给定条件下,下列所示的物质间的转化均能实现的是( )
A.HCl(浓)![]() Cl2
Cl2![]() FeCl3(aq)
FeCl3(aq)
B.Al![]() Al2O3
Al2O3![]() Al(OH)3
Al(OH)3
C.NaCl(熔融)![]() Na
Na![]() NaOH
NaOH
D.N2![]() NO2
NO2![]() HNO3
HNO3
科目:高中化学 来源: 题型:
【题目】I.金属矿物资源以及海水资源的利用有着非常重要的意义。
Ⅰ(1)金属铁常用的冶炼方法是____________(填序号);
A.热分解法 B.热还原法 C.电解法 D.湿法冶金
(2)利用冶炼得到的铁屑和海带中提取的碘可以用于生产KI,其工艺流程如图所示:
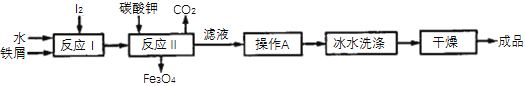
①操作A包括________________、_____________、过滤。
②用冰水洗涤的目的是:a除去附着在KI表面的可溶性杂质:b._________________。
③反应Ⅰ生成了铁与碘的化合物X,若X中铁元素与碘元素的质量比为21∶127,则X的化学式为__________________;反应Ⅱ中1molX完全反应生成89.6L(标准状况)CO2,写出反应Ⅱ的化学方程式:______________________________________________。
Ⅱ.工业上由黄铜矿(主要成分CuFeS2)冶炼铜的主要流程如下:

(3)气体A中的大气污染物可选用下列试剂中的____________吸收。
a.浓HSO4 b.稀HNO3 c.NaOH溶液 d.氨水
(4)用稀H2SO4浸泡熔渣B,取少量所得溶液,滴加KSCN溶液后呈红色,说明溶液中存在_____(填离子符号),检验溶液中还存在Fe2+的方案是:____________________________。
(5)在一定量的精铜中加入足量的稀HNO3溶液,该反应的离子方程式为________________。
(6)由泡铜冶炼粗铜的化学反应方程式为______________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
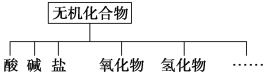
【题目】无机化合物可根据其组成和性质进行分类。
(1)如图所示的物质分类方法的名称是______________。
(2)
物质类别 | 酸 | 碱 | 盐 | 氧化物 | 氢化物 |
化学式 | ①HCl ②______ | ③________ ④Ba(OH)2 | ⑤Na2CO3 ⑥_______ | ⑦CO2 ⑧Na2O | ⑨NH3 ⑩H2O2 |
以Na、K、H、O、C、S、N中任两种或三种元素组成合适的物质,分别填在上表中②③⑥后面。
(3)写出⑦转化为⑤的化学方程式_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知HX的酸性比HY弱,在物质的量浓度均为0.1molL﹣1的NaX和NaY混合溶液中,下列排序正确的是( )
A. c(OH﹣)>c(HX)>c(HY)>c(H+)
B. c(OH﹣)>c(X﹣)>c(Y﹣)>c(H+)
C. c(OH﹣)>c(Y﹣)>c(X﹣)>c(H+)
D. c(OH﹣)>c(HY)>c(HX)>c(H+)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子方程式表达正确的是( )
A.向硫酸铁溶液中加入过量铁粉:Fe+2Fe3+=3Fe2+
B.向Na2CO3溶液中滴加稀盐酸:Na2CO3+2H+=2Na++CO2↑+H2O
C.向铜粉中加入稀硫酸:Cu+2H+=Cu2++H2↑
D.向铝粉中加入足量NaOH溶液:2Al+2OH-=2AlO![]() +H2↑
+H2↑
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】练江整治已刻不容缓,其中以印染工业造成的污染最为严重。某工厂拟综合处理含NH4+ 废水和工业废气(主要含N2、CO2、SO2、NO、CO),设计了如下工业流程:

下列说法错误的是
A. 气体I中主要含有的气体有N2、NO、CO
B. X在反应中作氧化剂,可通入过量的空气
C. 处理含NH4+废水时,发生离子方程式是:NH4++NO2-=N2↑+2H2O
D. 捕获剂所捕获的气体主要是CO
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】I.下列物质
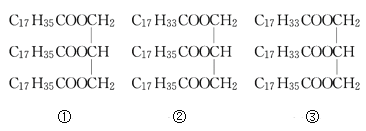
(1)属于简单甘油酯的是(填序号,下同)____,属于混合甘油酯的是______。
(2)①发生皂化反应的化学方程式为________。
Ⅱ.完成银镜反应实验:在AgNO3溶液中逐滴加入氨水,开始时在AgNO3溶液中出现白色沉淀,反应的离子方程式为_____,继续滴入氨水至沉淀溶解,反应的化学方程式为____,边滴边振荡直滴到______为止。再加入乙醛溶液后,水浴加热现象是____,化学方程式为:______
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫代硫酸钠(![]() )可用于照相业作定影剂。工业上可用反应:
)可用于照相业作定影剂。工业上可用反应:
![]() 制得。实验室模拟该工业过程制备硫代硫酸钠溶液(装置如图)。
制得。实验室模拟该工业过程制备硫代硫酸钠溶液(装置如图)。
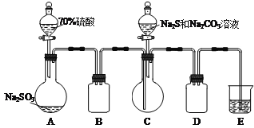
(1)装置A中反应的化学方程式___。
(2)装置B和D的作用是___。
(3)E中的试剂是___。
(4)反应一段时间后,装置C中得到产品是![]() ,其中还含有少量的
,其中还含有少量的![]() 。为测定装置C溶液中
。为测定装置C溶液中![]() 与
与![]() 的物质的量浓度之比,现进行如下实验:
的物质的量浓度之比,现进行如下实验:
步骤Ⅰ:取![]() 装置C烧瓶内的溶液置于锥形瓶中,加入足量的
装置C烧瓶内的溶液置于锥形瓶中,加入足量的![]() 溶液后再加入足量
溶液后再加入足量![]() 溶液,充分反应后,过滤,洗涤,干燥,得到固体的质量为
溶液,充分反应后,过滤,洗涤,干燥,得到固体的质量为![]() 。
。
步骤Ⅱ:另取![]() 装置C烧瓶内的溶液置于锥形瓶中,以淀粉作指示剂,用
装置C烧瓶内的溶液置于锥形瓶中,以淀粉作指示剂,用![]() 碘标准溶液滴定,滴定至终点消耗碘的标准溶液体积为
碘标准溶液滴定,滴定至终点消耗碘的标准溶液体积为![]() 。该步骤中发生的反应为
。该步骤中发生的反应为![]() ;计算装置C溶液中
;计算装置C溶液中![]() 与
与![]() 的物质的量浓度之比___(写出计算过程)。
的物质的量浓度之比___(写出计算过程)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】若某原子在处于能量最低状态时,外围电子排布为![]() ,则下列说法错误的是
,则下列说法错误的是
A. 该元素可能有+3价
B. 该元素位于第5周期副族
C. 该元素原子核外共有39个不同运动状态的电子
D. 该元素基态原子第N能层上还有5个空轨道
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com