
| A. | 乙酸是一种弱酸,不能和碳酸钙反应放出二氧化碳气体 | |
| B. | 润滑油属于酯类 | |
| C. | 没有成熟的苹果汁遇碘变蓝色,成熟的苹果汁能还原新制氢氧化铜悬浊液 | |
| D. | 糖类、油脂、蛋白质都是由C、H、O三种元素组成 |
分析 A、乙酸的酸性比碳酸强;
B、润滑油的主要成分是烃类物质;
C、淀粉遇碘单质变蓝色,葡萄糖能还原新制氢氧化铜悬浊液;
D、蛋白质中一定有C、H、O、N元素.
解答 解:A、乙酸为弱酸,但乙酸的酸性比碳酸强,能和碳酸钙反应放出二氧化碳气体,故A错误;
B、润滑油的主要成分为烃类物质,不属于酯类,故B错误;
C、没有成熟的苹果汁含有淀粉,成熟的含有葡萄糖,淀粉遇碘单质变蓝色,葡萄糖能还原新制氢氧化铜悬浊液,故C正确;
D、因蛋白质中一定有C、H、O、N元素,则糖类、油脂都是由C、H、O三种元素组成,故D错误.
故选C.
点评 本题考查了化学物质在生活中的应用,难度不大,属于基础型题目,注意基础的把握.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 氧化铝的熔点很高,所以不可以用来冶炼铝 | |
| B. | 氢氧化铝是一种胶状沉淀,有较大表面积,有吸附性,可用作净水剂 | |
| C. | 实验室可以用氢氧化钠与氯化铝来制备氢氧化铝 | |
| D. | 氢氧化铝既可与强酸反应又可与强碱反应,是两性氢氧化物 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
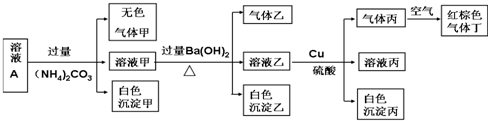
| A. | 该溶液中一定有上述离子中的NO3-、Al3+、SO42-、Cl-四种离子 | |
| B. | 实验消耗Cu 14.4g,则生成气体丁的体积为3.36L | |
| C. | 沉淀乙一定有BaCO3,可能有BaSO4 | |
| D. | 一定没有Fe3+,但是无法确定是否含有I- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
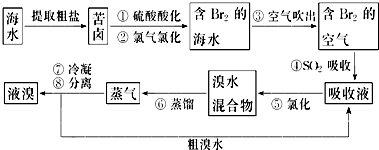
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
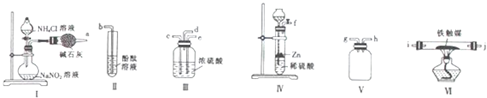
 f,e;d,i,j,g,h,b(填玻璃接口字母)
f,e;d,i,j,g,h,b(填玻璃接口字母)查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com