
| A. | 胶体区别于其他分散系的本质特征是丁达尔现象 | |
| B. | 将饱和FeCl3溶液逐滴加入NaOH溶液中可制备Fe(OH)3胶体 | |
| C. | Al(OH)3胶体能使水中的悬浮颗粒沉降,达到净水的目的 | |
| D. | 豆浆、蔗糖溶液均属于胶体 |
分析 A.胶体区别于其他分散系最本质的特征是胶体是分散质粒子直径的大小;
B.饱和FeCl3溶液和NaOH溶液反应生成氢氧化铁沉淀;
C.胶体具有较大的表面积,能吸附水中悬浮的固体颗粒;
D.蔗糖溶液属于溶液.
解答 解:A.胶体区别于其他分散系最本质的特征是胶体是分散质粒子直径10-9-10-7m之间,故A错误;
B.反应生成沉淀,而实验室制备氢氧化铁胶体是把饱和氯化铁溶液滴入沸水中加热到呈红褐色液体,即得到氢氧化铁胶体,故B错误;
C.Al(OH)3胶体具有较大的表面积,能够使水中悬浮的固体颗粒沉降,达到净水目的,故C正确;
D.豆浆属于胶体,蔗糖溶液属于溶液,故D错误.
故选C.
点评 本题考查胶体的特性以及溶液和胶体的本质区别,熟悉胶体的性质是解答的关键,题目较简单.


 冲刺100分单元优化练考卷系列答案
冲刺100分单元优化练考卷系列答案科目:高中化学 来源: 题型:解答题

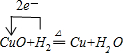
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
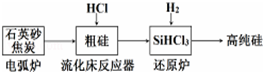
| 发生的主要反应 | |
| 电弧炉 | SiO2+2C$\frac{\underline{\;1600-1800℃\;}}{\;}$si+2CO |
| 流化床反应器 | Si+3HCl$\frac{\underline{\;250-300\;}}{\;}$SiHCl3+H2 |
| 还原炉 |
| 物质 | Si | SiCl4 | SiHCl3 | SiH2Cl2 | SiH3Cl | HCl | SiH4 |
| 沸点/°C | 2355 | 57.6 | 31.8 | 8.2 | -30.4 | -84.9 | -111.9 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 温度/K | 锌 | c(Zn2+)/mol/L | c(H+)/mol/L | 另加溶液 |
| A | 281 | 锌块 | 0.1 | 3 | |
| B | 308 | 锌粉 | 0.2 | 3 | 少量氯化铜 |
| C | 281 | 锌块 | 0.1 | 2 | |
| D | 308 | 锌粉 | 0.1 | 3 | 少量氯化钡 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | H+、CO32-、NO3- | B. | Cu2+、Cl-、OH- | C. | Na+、Cl-、HCO3- | D. | Ag+、K+、Cl- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 硫酸钡难溶于水,其水溶液导电能力极弱,所以硫酸钡不是电解质 | |
| B. | CO2溶于水得到的溶液能导电,所以CO2是电解质 | |
| C. | 酸、碱和盐类都属于电解质,其他物质都是非电解质 | |
| D. | 电解质与非电解质的本质区别是在水溶液或熔化状态下能否电离 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 常温下,50g SO2和CO2的混合气体中可能含有2NA个氧原子 | |
| B. | I mol Cl2与足量的铁反应,转移的电子数为3NA | |
| C. | 1 L0.1 mol•L-1氨水含有0.l NA个OH- | |
| D. | I mol乙醇中含有C-H键的数目为6NA |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com