
 PCl3和Cl2在一定条件下反应生成PCl5.
PCl3和Cl2在一定条件下反应生成PCl5.分析 (1)常温常压下,PCl3为液态,PCl5为固态,PCl3与Cl2反应生成41.7 g PCl5即0.2molPCl5时放出热量24.76kJ,据此可知当生成1molPCl5时放出热量123.8kJ,据此写出热化学方程式;
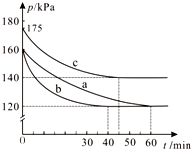
(2)①分析图象可知达到平衡状态的时间不同,时间越短反应速率越快;其中b和a达到相同平衡状态,但时间不同,说明b是加入了催化剂改变了反应速率;c混合气体压强增大,达到平衡时间缩短,所以是升温引起的压强增大;
②设PCl3与Cl2反应达平衡后生成PCl5物质的量为x mol,根据三段式,表示出各物质的平衡的物质的量,然后根据在恒容时,气体的物质的量之比等于压强之比,求出X,即可解得K和平衡转化率.
解答 解:(1)常温常压下,PCl3为液态,PCl5为固态,PCl3与Cl2反应生成41.7 g PCl5即0.2molPCl5时放出热量24.76kJ,据此可知当生成1molPCl5时放出热量123.8kJ,故热化学方程式为:PCl3(l)+Cl2)g)═PCl5(s)△H=-123.8 kJ/mol,故答案为:PCl3(l)+Cl2)g)═PCl5(s)△H=-123.8 kJ/mol;
(2)①分析图象可知达到平衡状态的时间不同,时间越短反应速率越快,图中3组实验从反应开始至达到平衡时的反应速率v(PCl3)由大到小的次序b>c>a,与实验a相比,b和a达到相同平衡状态,但时间不同,b组改变的实验条件及判断依据是加入了催化剂改变了反应速率;c混合气体压强增大,达到平衡时间缩短,所以是升温引起的压强增大;
故答案为:加入催化剂,升高温度;
②解:设PCl3与Cl2反应达平衡后生成PCl5物质的量为x mol.
PCl3(g)+Cl2(g)?PCl5(g)
初始/mol 0.1 0.1 0
平衡/mol 0.1-x 0.1-x x
初始时容器中气体总物质的量为0.2 mol,平衡时容器内气体总物质的量为:
(0.1-x) mol+(0.1-x) mol+x mol=(0.2-x) mol
根据物质的量之比等于压强之比可知:
$\frac{0.2mol}{(0.2-x)mol}=\frac{160Kp}{120KP}$ 解得 x=0.05 mol
各物质的平衡浓度:c(PCl5)=c(PCl3)=c(Cl2)=$\frac{(0.1-0.06)mol}{5L}$=0.01 mol/L
K=$\frac{c(PC{l}_{5})}{c(PC{l}_{3})•c(C{l}_{2})}$=$\frac{0.01mol/L}{0.01mol/L×0.01mol/L}$=100 mol/L
Cl2的转化率α(Cl2)=$\frac{0.05mol}{0.1mol}$×100%=50%
答:实验a中反应的平衡常数为100mol/L,Cl2的转化率为50%.
点评 本题考查了图象分析判断方法,化学平衡计算分析,影响化学平衡的因素理解应用,反应速率概念的计算,掌握基础是关键,题目难度中等.


 云南师大附小一线名师提优作业系列答案
云南师大附小一线名师提优作业系列答案 冲刺100分单元优化练考卷系列答案
冲刺100分单元优化练考卷系列答案科目:高中化学 来源: 题型:选择题
| A. | 标准状况下,22.4LH2O含有的分子数为NA | |
| B. | 标准状况下,22.4L 氖气含有的氖原子数为2 NA | |
| C. | 常温常压下,22.4L CO2气体含有的分子数为NA | |
| D. | 在1L的0.5mol•/L的MgCl2溶液中,含Cl- 数为NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 已知:25℃时,CH3COOH和NH3•H2O的电离常数相等.
已知:25℃时,CH3COOH和NH3•H2O的电离常数相等.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用润湿的pH试纸测稀酸溶液的pH,测定值偏小 | |
| B. | 用容量瓶配制溶液,定容时俯视刻度线,所配溶液浓度偏大 | |
| C. | 滴定前滴定管内有气泡,终点读数时无气泡,所测体积偏小 | |
| D. | 测定中和反应的反应热时,将碱缓慢倒入酸中,所测温度值偏大 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1 | B. | 2 | C. | 3 | D. | 4 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
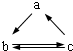 下表所列各组物质中,物质之间通过一步反应就能实现如图所示转化的是( )
下表所列各组物质中,物质之间通过一步反应就能实现如图所示转化的是( ) | a | b | c |
| A | Al | AlCl3 | Al(OH)3 |
| B | HNO3 | NO | NO2 |
| C | Si | SiO2 | H2SiO3 |
| D | Na2O2 | Na2CO3 | NaHCO3 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com