
【题目】下列物质中属于烃的是 ( )
A.CH3C1B.硝基苯C.乙烯D.CH3CH2OH
科目:高中化学 来源: 题型:
【题目】将钠、铝混合物,放入足量的水中,反应停止后,还有不溶物,则此时溶液中溶质为
A.NaOHB.NaAlO2C.NaOH和NaAlO2D.无法确定
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学设计实验证明铜与浓硫酸能发生反应,并检验生成气体的性质,如图所示,在试管里加入2mL浓硫酸,用带导管和一个小孔的胶管塞紧,从孔中插入一根铜丝,加热,把放出的气体依次通入品红溶液和石蕊溶液中. 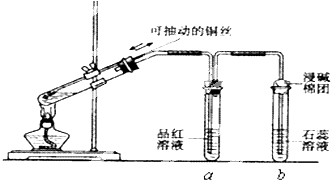
请回答下列问题:
(1)写出铜与浓硫酸反应的化学方程式: .
(2)试管a、b分别检验生成气体的性质,写出观察到的现象及其作用.试管a中的现象是 , 作用是 . 试管b中的现象是 , 作用是 .
(3)装置中浸碱面团的作用是 .
(4)如图将铜丝改为可抽动的铜丝符合化学实验“绿色化”的原因是 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列依据热化学方程式得出的结论正确的是( )
A. 常温常压下,1 g H2在足量Cl2中燃烧生成HCl,放出92.3 kJ的热量,则热化学方程式可表示为H2(g)+Cl2(g)2HCl(g) ΔH=+184.6 kJ·mol-1
B. 甲烷的标准燃烧热为ΔH=-890.3 kJ·mol-1,则甲烷燃烧的热化学方程式可表示为CH4(g)+2O2(g)CO2(g)+2H2O(g) ΔH=-890.3 kJ·mol-1
C. 已知NaOH(aq)+HCl(aq)NaCl(aq)+H2O(l) ΔH=-57.4 kJ·mol-1,则含20.0 g NaOH的稀溶液与稀盐酸完全中和,放出28.7 kJ的热量
D. 相同条件下,2 mol氢原子所具有的能量小于1 mol氢分子所具有的能量
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述正确的是( )
A. Na2SiO3是硅酸盐,但不能溶于水
B. 电影银幕用水玻璃浸泡,主要是为了防腐
C. 建筑工业常用水玻璃作黏合剂
D. 用水玻璃浸泡铁道的木制枕木,主要是为了防火
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学兴趣小组同学展开对漂白剂亚氯酸钠(NaClO2)的研究。

已知:①NaClO2饱和溶液在温度低于38℃时析出晶体是NaClO23H2O,高于38℃时析出晶体是NaClO2,高于60℃时NaClO2分解成NaClO3和NaCl;
②二氧化氯极易溶于水。
(1)装置A中NaClO3和Na2SO3制备ClO2气体,其物质的量的理论比值为____________;该装置中采用浓硫酸而不用稀硫酸的原因是___________。
(2)装置B的作用是 _____________;装置C中反应为放热反应,在不改变反应物浓度和体积的条件下,为了使反应在低温下进行,实验中可采取的措施是________________。
(3)写出装置C发生的离子方程式______________。
(4)从装置C反应后的溶液获得干燥的NaClO2晶体的操作步骤为:将装置C中的液体取出在减压和55℃条件下蒸发,至出现大量晶体后,___________________(填实验步骤)。(已知:NaClO2晶体易溶于水,难溶解于乙醇等有机溶剂。)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业燃烧煤、石油等化石燃料释放出大量氮氧化物(NOx)、CO2、SO2等气体,严重污染空气.对废气进行脱硝、脱碳和脱硫处理可实现绿色环保、废物利用.
Ⅰ.脱硝:已知:H2的燃烧热为285.8 kJmol﹣1
N2(g)+2O2(g)═2NO2(g)△H=+133kJmol﹣1
H2O(g)═H2O(l)△H=﹣44kJmol﹣1
催化剂存在下,H2还原NO2生成水蒸气和其它无毒物质的热化学方程式为______________。
Ⅱ.脱碳:向2L密闭容器中加入2mol CO2、6mol H2,在适当的催化剂作用下,发生反应:CO2(g)+3H2(g)═CH3OH(l)+H2O(l)
(1)①已知该反应能自发进行,则△H____0(填“大于”、“小于”或“等于”)
②如图,t2时CO2的转化率=_____________

(2)改变温度,使反应CO2(g)+3H2(g)═CH3OH(g)+H2O(g)△H<0 中的所有物质
都为气态.起始温度体积相同(T1℃、2L密闭容器).反应过程中部分数据见下表:
反应时间 | CO2(mol) | H2(mol) | CH3OH(mol) | H2O(mol) | |
反应I 恒温恒容 | 0min | 2 | 6 | 0 | 0 |
10min | 4.5 | ||||
20min | 1 | ||||
30min | 1 | ||||
反应II 绝热恒容 | 0min | 0 | 0 | 2 | 2 |
①达到平衡时,反应Ⅰ、Ⅱ对比:平衡常数K(Ⅰ)______K(Ⅱ)(填“>”、“<”或“=”下同);平衡时CH3OH的浓度c(Ⅰ)______c(Ⅱ).
②对反应Ⅰ,前10min内的平均反应速率v(CH3OH)=______,在其它条件不变下,若30min时只改变温度为T2℃,此时H2的物质的量为3.2mol,则T1______T2(填“>”、“<”或“=”).若30min时只向容器中再充入1mol CO2(g)和1mol H2O(g),则平衡______移动(填“正向”、“逆向”或“不”).
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在温度不变的条件下,在恒容的容器中进行下列反应:N2O4(g)═2NO2(g),若N2O4的浓度由0.1molL﹣1降到0.07molL﹣1需要15s,那么N2O4的浓度由0.07molL﹣1降到0.05molL﹣1所需的反应时间( )
A.等于5s
B.等于10s
C.小于10s
D.大于10s
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法中正确的是( )
A.通常元素的化合价与其原子的质量数有密切的关系
B.已知铱的一种核素是 ![]() Ir,则其核内的中子数是114
Ir,则其核内的中子数是114
C.![]() C和
C和 ![]() N的质量数相同,但质子数不同,所以互称为同位素
N的质量数相同,但质子数不同,所以互称为同位素
D.钾的原子结构示意图为 ![]()
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com