
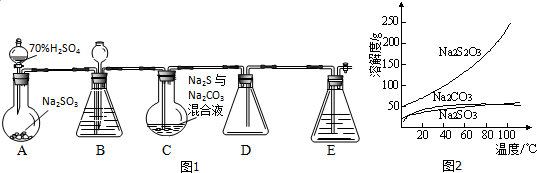
分析 (1)根据装置图可知仪器名称;
(2)由于本装置中有气体参加,所以实验前要检验装置的气密性;
(3)①二氧化硫与碳酸钠反应可生成亚硫酸钠;
②Na2S2O3中主要含有Na2CO3、Na2SO3两种杂质,根据溶解度曲线,Na2CO3、Na2SO3溶解度受温度影响较小,而Na2S2O3受温度影响较大,据此答题;
(4)K2Cr2O7的物质的量为0.1mol/L×0.02L=0.002mol,根据反应Cr2O72-+6I-+14H+=2Cr3++3I2+7H2O可知,I2的物质的量为0.006mol,根据反应I2+2S2O32-=2I-+S4O62-,可知Na2S2O3的物质的量为0.012mol,据此计算该产品的纯度;
解答 解:(1)根据装置图可知A中盛放70%H2SO4的仪器的名称为分液漏斗,
故答案为:分液漏斗;
(2)由于本装置中有气体参加,所以实验前要检验装置的气密性,所以向装置中的长颈漏斗内注入一定量的液体,其目的是检查装置气密性,
故答案为:检查装置气密性;
(3)①二氧化硫与碳酸钠反应可生成亚硫酸钠,反应的方程式为Na2CO3+SO2=Na2SO3+CO2,
故答案为:Na2CO3+SO2=Na2SO3+CO2;
②Na2S2O3中主要含有Na2CO3、Na2SO3两种杂质,根据溶解度曲线,Na2CO3、Na2SO3溶解度受温度影响较小,而Na2S2O3受温度影响较大,所以从混合溶液中制得Na2S2O3的操作步骤为蒸发浓缩、降温结晶、过滤、洗涤、干燥,
故答案为:蒸发浓缩、降温结晶;
(4)K2Cr2O7的物质的量为0.1mol/L×0.02L=0.002mol,根据反应Cr2O72-+6I-+14H+=2Cr3++3I2+7H2O可知,I2的物质的量为0.006mol,根据反应I2+2S2O32-=2I-+S4O62-,可知Na2S2O3的物质的量为0.012mol,所以2.0g产品含有Na2S2O3的质量为0.012mol×158g/mol=0.1896g,所以产品的纯度为$\frac{0.1896g}{2g}$×100%=94.8%,
答:该产品的纯度为94.8%.
点评 本题考查了实验基本操作、氧化还原反应的计算等,题目难度中等,为高频考点,侧重于学生的分析能力和计算能力的考查,注意守恒思想在氧化还原反应计算中应用.


科目:高中化学 来源: 题型:解答题

 .
.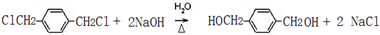 ;
;查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ④>①>③>② | B. | ④=①>③>② | C. | ①>④>③>② | D. | ①=④>③=② |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 化学材料的研发和使用,为开发太阳能资源,寻求经济发展的新动力提供有力支撑,请根据你所学知识回答:
化学材料的研发和使用,为开发太阳能资源,寻求经济发展的新动力提供有力支撑,请根据你所学知识回答:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ${\;}_{1}^{1}$H2、${\;}_{1}^{2}$H2、${\;}_{1}^{3}$H2 | B. | ${\;}_{6}^{12}$C、${\;}_{6}^{14}$C | ||
| C. | D2O、H2O | D. | 金刚石、石墨 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com