
【题目】已知草酸(H2C2O4)为二元弱酸,25℃时,Ka1(H2C2O4)=5.9×10-2,Ka2(H2C2O4)=6.4×10-5。用NaOH溶液滴定草酸氢钾(KHC2O4)溶液,混合溶液的相对导电能力随加入NaOH体积的变化如图所示(忽略混合时溶液温度的变化),其中N点为反应终点。下列有关描述中正确的是
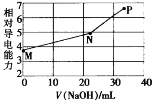
A.M点粒子浓度:c(K+)>c(![]() )>c(
)>c(![]() )>c(H2C2O4)
)>c(H2C2O4)
B.N点时存在:c(Na+)+c(K+)<2c(![]() )+2c(
)+2c(![]() )
)
C.从N点到P点的过程中溶液中一定存在:c(Na+)+c(H2C2O4)>c(![]() )
)
D.水的电离程度大小顺序:P>N>M
【答案】AC
【解析】
M点时还未加入氢氧化钠溶液,体系中为KHC2O4溶液,根据电离平衡常数判断![]() 水解和电离程度的大小;N点为反应终点:2NaOH+2KHC2O4=2H2O+ K2C2O4+ Na2C2O4,P中存在K2C2O4、Na2C2O4和过量的NaOH,可水解的盐促进水的电离、酸和碱抑制水的电离,由此进行解题。
水解和电离程度的大小;N点为反应终点:2NaOH+2KHC2O4=2H2O+ K2C2O4+ Na2C2O4,P中存在K2C2O4、Na2C2O4和过量的NaOH,可水解的盐促进水的电离、酸和碱抑制水的电离,由此进行解题。
A.M点时还未加入氢氧化钠溶液,体系中为KHC2O4溶液,HC2O4-会水解:![]() +H2OH2C2O4+OH-, Kh(
+H2OH2C2O4+OH-, Kh(![]() )=
)=![]() =
=![]() =
=![]() =1.7×10-13,HC2O4-也会电离:
=1.7×10-13,HC2O4-也会电离:![]()
![]() +H+,由于Kh(
+H+,由于Kh(![]() )<Ka2,草酸氢根在溶液中的电离程度大于其水解程度,显酸性,故粒子浓度:c(K+)>c(
)<Ka2,草酸氢根在溶液中的电离程度大于其水解程度,显酸性,故粒子浓度:c(K+)>c(![]() )>c(
)>c(![]() )>c(H2C2O4),A正确;
)>c(H2C2O4),A正确;
B.N点为反应终点:2NaOH+2KHC2O4=2H2O+ K2C2O4+ Na2C2O4,根据物料守恒可推出:c(Na+)+c(K+)=2c(![]() )+2c(
)+2c(![]() )+2c(H2C2O4),所以N点时存在:c(Na+)+c(K+)>2c(
)+2c(H2C2O4),所以N点时存在:c(Na+)+c(K+)>2c(![]() )+2c(
)+2c(![]() ),B错误;
),B错误;
C.从N点到P点的过程中,溶液中存在K2C2O4、Na2C2O4和NaOH (K2C2O4:Na2C2O4=1:1),![]() 水解生成
水解生成![]() 、H2C2O4,故c(Na+)>c(
、H2C2O4,故c(Na+)>c(![]() ),故溶液中一定存在:c(Na+)+c(H2C2O4)>c(
),故溶液中一定存在:c(Na+)+c(H2C2O4)>c(![]() ),C正确;
),C正确;
D.根据A项分析,M点![]() 的微弱电离抑制水的电离,N点由于
的微弱电离抑制水的电离,N点由于![]() 的水解促进水的电离,P中存在过量的NaOH抑制水的电离,则水的电离程度大小顺序为: N>M>P,D错误;
的水解促进水的电离,P中存在过量的NaOH抑制水的电离,则水的电离程度大小顺序为: N>M>P,D错误;
答案选AC。


 高中必刷题系列答案
高中必刷题系列答案科目:高中化学 来源: 题型:
【题目】合理控制、利用燃煤排放的CO2、SO2、CO是优化环境的有效途径。
(1)CO2生产甲醇方法:CO2(g)+3H2(g) ![]() CH3OH(g)+H2O(g) ΔH =a kJ·mol1;
CH3OH(g)+H2O(g) ΔH =a kJ·mol1;
已知:2H2(g)+O2(g)===2H2O(g) ΔH=b kJ·mol1;
H2O(g)===H2O(l) ΔH=c kJ·mol1;
CH3OH(g)===CH3OH(l) ΔH=d kJ·mol1。
则表示CH3OH(l)燃烧热的热化学方程式为_________________________________。
(2)工业生产中用SO2为原料制取硫酸
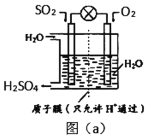
①利用原电池将SO2 转化法,如图(a)所示,则负极的电极反应式为____________。
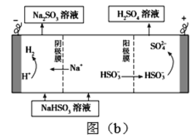
②电解Na2SO3溶液吸收SO2得到的NaHSO3法,如图(b)所示,则阳极反应式______。
(3)光气 (COCl2)是一种重要的化工原料,工业上通过Cl2(g)+CO(g) ![]() COCl2(g)的反应制备。根据图(c)、图(d),回答下列问题:
COCl2(g)的反应制备。根据图(c)、图(d),回答下列问题:
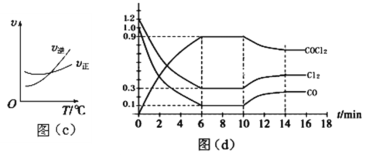
①该反应的正反应是___________ 反应(填“放热”或“吸热”)。
②0~6 min内,反应的平均速率v(Cl2)=_______;该温度下的平衡常数为______。
③若恒温恒容时,在第7 min 向体系中加入这三种物质各2 mol,则平衡_____移动(填“向左”、“向右”或“不”)。
④若恒温恒压时,初始投料浓度为c(Cl2)=0.7 mol/L、c(CO)=0.5 mol·L1、c(COCl2)=______mol·L1,最终达到化学平衡时,Cl2的体积分数与上述第6 min时的相同。
⑤第n min反应温度表示为T(n ),则:T(8)_____T(15) (填“>”、“<”或“=”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如右图装置为某新型燃料电池的工作示意图,以HCl-NH4Cl溶液为电解质溶液。下列有关说法中正确的是( )
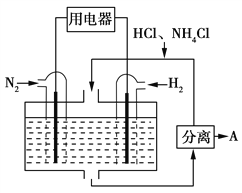
A. 通入H2的电极为正极
B. 该电池的负极反应式为:N2+6e-+8H+===2NH![]()
C. 图中分离出的A物质为NH4Cl
D. 该电池工作一段时间后,溶液的pH减小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验操作不能达到相应实验目的的是
选项 | 实验操作 | 实验目的 |
A | 向苯与液溴的混合液中加入铁粉,将产生的气体直接通入AgNO3溶液中 | 验证液溴与苯发生取代反应 |
B | 向5mL浓度为0.5mol·L-1的KI溶液中滴加少量氯化铁溶液,再加入少量淀粉溶液,振荡 | 比较I-、Fe2+的还原性强弱 |
C | 向5mL浓度为0.2mol·L-1的MgCl2溶液中滴加少量NaOH溶液,待有白色沉淀生成后,再滴加0.2mol·L-1的CuCl2溶液 | 比较Cu(OH)2、Mg(OH)2溶度积的大小 |
D | 向 | 验证与H+的结合能力: |
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】国产航母山东舰已经列装服役,它是采用模块制造然后焊接组装而成的,对焊接有着极高的要求。实验室模拟在海水环境和河水环境下对焊接金属材料使用的影响(如图)。下列相关描述中正确的是
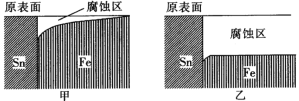
A.由图示的金属腐蚀情况说明了Sn元素的金属性强于Fe元素
B.由图示可以看出甲是海水环境下的腐蚀情况,乙是河水环境下的腐蚀情况
C.两种环境下铁被腐蚀时的电极反应式均为Fe-3e-=Fe3+
D.为了防止舰艇在海水中被腐蚀,可在焊点附近用锌块打“补丁”
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述中不正确的是( )
A.第ⅠA族的金属元素是同一周期中金属性最强的元素
B.P、S、Cl得电子能力和最高价氧化物对应水化物的酸性均依次增强
C.元素周期表中位于金属和非金属分界线附近的元素属于过渡元素
D.主族元素原子的最外层电子数不一定等于该元素的最高正化合价
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】表为元素周期表短周期的一部分,下列有关A、B、C、D四种元素的叙述正确的是( )
A | B | C | ||
D | ||||
A.原子半径大小比较为D>C>B>A
B.生成的氢化物分子间均可形成氢键
C.A与C形成的阴离子可能有AC![]() 、A2C
、A2C![]()
D.A、B、C、D的单质常温下均不导电
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】科学家最近研制出可望成为高效火箭推进剂的![]() (如下图所示)。已知该分子中N-N-N键角都是108.1°,下列有关
(如下图所示)。已知该分子中N-N-N键角都是108.1°,下列有关![]() 的说法正确的是
的说法正确的是
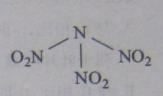
A. 分子中N、O间形成的共价键是非极性键
B. 分子中四个氮原子共平面
C. 该物质既有氧化性又有还原性
D. 15.2g该物资含有6.02×![]() 个原子
个原子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上处理含苯酚废水的过程如下。回答下列问题:
I.测定废水中苯酚的含量。
测定原理:![]() +3Br2→
+3Br2→ ↓+3HBr
↓+3HBr
测定步骤:
步骤1:准确量取25.00mL待测废水于250mL锥形瓶中。
步骤2:将5.00mLamol/L浓溴水(过量)迅速加入到锥形瓶中,塞紧瓶塞,振荡。
步骤3:打开瓶塞,向锥形瓶中迅速加入bmL0.10mol/LKI溶液(过量),塞紧瓶塞,振荡。
步骤4:以淀粉作指示剂,用0.010mol/LNa2S2O3标准溶液滴定至终点,消耗Na2S2O3标准溶液V1mL。(反应原理:I2+2Na2S2O3=2NaI+Na2S4O6)
把待测废水换为蒸馏水,重复上述各步骤(即进行空白实验),消耗Na2S2O3标准溶液V2mL(以上数据均已扣除干扰因素)。
(1)步骤1中量取待测废水所用仪器是_________。
(2)步骤2中塞紧瓶塞的原因是_________。
(3)步骤4中滴定终点的现象为_________。
(4)该废水中苯酚的含量为_________mg/L(用含V1、V2的代数式表示)。
(5)如果“步骤4”滴定至终点时仰视读数,则测得消耗Na2S2O3标准溶液的体积_____V1mL(填“偏大”、“偏小”或“无影响”,下同);如果空白实验中的“步骤2”忘记塞紧瓶塞,则测得的废水中苯酚的含量_________。
II.处理废水。
采用Ti基PbO2为阳极,不锈钢为阴极,含苯酚的废水为电解液,通过电解,阳极上产生羟基(OH),阴极上产生H2O2。通过交替排列的阴阳两极的协同作用,在各自区域将苯酚深度氧化为CO2和H2O。
(6)写出阳极的电极反应式:_________。
(7)写出苯酚在阴极附近被H2O2深度氧化的化学方程式:_________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com