
有6.85g铅的氧化物,用足量的CO 在高温下将其还原,把生成的全部CO2通入到足量的澄清的石灰水中得到4.00g固体沉淀物,这种铅的氧化物的化学式为
A. PbO B. PbO2
C. Pb3O4 D. Pb3O4和PbO2的混合物
C
【解析】
试题分析:4.00g固体沉淀物为碳酸钙沉淀,则n(CaCO3)=4.00g÷100g/mol=0.04mol,铅氧化物中的氧原子被CO夺取生成CO2,根据碳元素、氧元素守恒可知CO~O~CO2~CaCO3,所以铅氧化物中的氧原子的物质的量为0.04mol,氧元素的质量为0.04mol×16g/mol=0.64g,则铅氧化物中的铅元素的质量为6.85g-0.64g=6.21g,其物质的量为
6.21g ÷ 207g/mol=0.03mol,所以铅氧化物中铅原子与氧原子的物质的量之比为=0.03mol:0.04mol=3:4,因此铅氧化物的化学式为Pb3O4,故C项正确。
考点:本题考查化学计算。


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源:2013-2014安徽省高二(下)期末考试化学试卷(解析版) 题型:选择题
与CH2=CH2?CH2Br—CH2Br的变化属于同一反应类型的是( )
A.CH3CHO?C2H5OH B.C2H5Cl?CH2=CH2
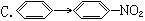 D.CH3COOH?CH3COOC2H5
D.CH3COOH?CH3COOC2H5
查看答案和解析>>
科目:高中化学 来源:2013-2014安徽省、合肥六中第二学期期末联考高一化学试卷(解析版) 题型:选择题
某铁合金与铁的物理性质的比较如下表所示:
| 熔点(℃) | 密度 (g /cm3) | 硬度(金刚石为10) | 导电性 (银为100) |
某铁合金 | 2500 | 3.00 | 7.4 | 2.3 |
铁 | 1535 | 7.86 | 4.5 | 17 |
又知该铁合金耐腐蚀,强度大。从以上性能看,该铁合金不适合用作( )
A.导线 B.门窗框 C.炉具 D.飞机外壳
查看答案和解析>>
科目:高中化学 来源:2013-2014安徽省合肥市高三第三次教学质量检测理综化学试卷(解析版) 题型:选择题
某电化学实验装置如图所示,下列说法正确的是
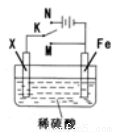
A.若X为碳棒,开关K置于M处,则溶液中的H+移向Fe极
B.若X为碳棒,开关K置于N处,转移0.2mole一时析出0.lmolO2
C.若X为铜棒,开关K置于M或N处,均可减缓铁的腐蚀
D.若X为锌棒,开关K置于M或N处,锌电极上反应均为Zn-2e一=Zn2+
查看答案和解析>>
科目:高中化学 来源:2013-2014宁夏银川市高三第二次模拟考试理综化学试卷(解析版) 题型:填空题
【化学—--选修3:物质结构与性质】(15分)
金属铜与金属锰及其化合物在工业上有着广泛的应用:
(1)Cu2+的外围电子排布图可表示为 ;
(2)Mn基态原子核外处在能量最高的能级上的电子共有 种不同的运动状态;
(3)在铜锰氧化物的催化下,空气中CO被氧化成CO2,HCHO被氧化成CO2和H2O
① N3-和CO2是等电子体,则N3-的结构式为 ;
② HCHO分子中C原子轨道的杂化类型为 ;
(4)向CuSO4溶液中加入过量NaOH溶液可生成[Cu(OH)4]2-。不考虑空间构型,[Cu(OH)4]2-的结构可用示意图表示为 ;
(5) 用晶体的x射线衍射法可以测得阿伏加德罗常数。对金属铜的测定得到以下结果:晶胞为面心立方最密堆积,边长为361pm(提示:3.613=47.05),又知铜的密度为9.00g·cm-3,则铜晶胞的质量是
g(保留两位小数);阿伏加德罗常数为 (列式计算,保留两位小数)。
查看答案和解析>>
科目:高中化学 来源:2013-2014宁夏银川市高三第二次模拟考试理综化学试卷(解析版) 题型:选择题
莽草酸的结构简式如图,下列关于莽草酸的说法不正确的是
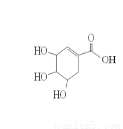
A.相同条件下等物质的量的莽草酸和正戊醛(C5H10O)完全燃烧时的耗氧量相同
B.分子中含有两种含氧官能团,可发生取代反应
C.1mol莽草酸既可与2mol氢气发生加成反应,也可与4molNaOH发生中和反应
D.可用溴水鉴别莽草酸、乙醇、四氯化碳和苯
查看答案和解析>>
科目:高中化学 来源:2013-2014宁夏高二下学期期末考试化学试卷(解析版) 题型:选择题
如图是氯化铯晶体的晶胞示意图(晶体中最小的重复结构单元),

已知晶体中2个最近的Cs+核间距为a cm,氯化铯(CsCl)的相对
分子质量M,NA为阿伏加德罗常数,则氯化铯晶体的密度为( )
A. g· cm-3 B.
g· cm-3 B. g· cm-3
g· cm-3
C. g· cm-3 D.
g· cm-3 D. g· cm-3
g· cm-3
查看答案和解析>>
科目:高中化学 来源:2013-2014宁夏高二下学期期末考试化学试卷(解析版) 题型:选择题
下列说法或有关化学用语的表达正确的是( )
A.在基态多电子原子中,p轨道电子能量一定高于s轨道电子能量
B.基态Fe原子的外围电子排布图为:
C.因氧元素电负性比氮元素大,故氧原子第一电离能比氮原子第一电离能大
D.根据原子核外电子排布的特点,Cu在周期表中属于s区元素
查看答案和解析>>
科目:高中化学 来源:2013-2014学年陕西省五校高三第三联考理综化学试卷(解析版) 题型:填空题
开发新型储氢材料是氢能利用的重要研究方向。
(1)Ti(BH4)3是一种储氢材料,可由TiCl4和LiBH4反应制得。
①基态Ti3+的未成对电子数有______个。
②LiBH4由Li+和BH4-构成,BH4-的等电子体是 (写一种)。LiBH4中不存在的作用力有___(填标号)。
A.离子键 B.共价键 C.金属键 D.配位键
③Li、B、H元素的电负性由大到小排列顺序为_ _____。
(2)金属氢化物是具有良好发展前景的储氢材料。
①LiH中,离子半径:Li+______H-(填“>”、“=”或“<”)。
②某储氢材料是短周期金属元素M的氢化物。M的部分电离能如下表所示:
I1/KJ·mol-1 | I2/KJ·mol-1 | I3/KJ·mol-1 | I4/KJ·mol-1 | I5/KJ·mol-1 |
738 | 1451 | 7733 | 10540 | 13630 |
M是______(填元素符号)。
(3)某种新型储氧材料的理论结构模型如下图所示,图中虚线框内碳原子的杂化轨道类型有____种。

(4)若已知元素电负性氟大于氧,试解释沸点H2O高于HF 。
分子X可以通过氢键形成“笼状结构”而成为潜在的储氢材料。X—定不是______(填标号)。
A.H2O B.CH4 C.HF D.CO(NH2)2
(5)纳米材料的表面粒子数占总粒子数的比例极大,这是它具有许多特殊性质的原因。假设某氯化钠纳米颗粒的大小和形状恰好与氯化钠晶胞的大小和形状相同。则这种纳米颗粒的表面粒子数占总粒子数的百分数为 。

A.87.5% B.92.9% C.96.3% D.100%
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com