
【题目】抗酸药有效成分有:碳酸氢钠、碳酸钙、碳酸镁、氢氧化铝、氢氧化镁等,请写出胃酸与氢氧化铝反应的化学方程式____________________________________________;再写出碳酸氢钠与胃酸反应的离子方程式_________________________________________。
科目:高中化学 来源: 题型:
【题目】氨基酸分子之间通过氨基与羧基间的取代反应可生成多肽与水,现有两种氨基酸间的反应为:aCH3—CH(NH2)COOH+bH2N—(CH2)4CH(NH2)COOH―→C30H58O8N10+dH2O,则a∶b等于( )
A. 4∶3 B. 2∶3
C. 3∶2 D. 3∶4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】室温下,将100 mL的NaOH和Ba(OH)2混合碱溶液分成两等份,一份加入过量的Na2SO4溶液,充分反应后得到沉淀2.33 g;另一份加入50 mL0.1 mol/LH2SO4溶液,充分反应后溶液中c(OH-)为0.3 mol/L(此时溶液的体积为100 mL),试计算:
(1)原混合碱溶液中所含Ba(OH)2的物质的量是________。
(2)原混合溶液中NaOH的物质的量浓度是___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的( )
A.凡是需要加热才能发生的反应都是非自发进行的
B.凡是放热反应都是自发的
C. 自发反应都是熵增大的反应
D.吸热反应可能属于自发反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D、E是核电荷数依次增大的五种短周期主族元素,A元素的原子核内只有1个质子;B元素的原子半径是其所在主族中最小的,B的最高价氧化物对应水化物的化学式为HBO3;C元素原子的最外层电子数比次外层多4;C的阴离子与D的阳离子具有相同的电子排布,两元素可形成化合物D2C;C、E同主族。
(1)B在周期表中的位置为第________周期第________族。
(2)E元素形成的氧化物对应的水化物的化学式为________________________。
(3)元素C、D、E形成的简单离子半径大小关系是______>________>________(用离子符号表示)。
(4)用电子式表示化合物D2C的形成过程:____________________。C、D还可形成化合物D2C2,D2C2中含有的化学键是_________________________。
(5)由A、B、C三种元素形成的离子化合物的化学式为__________________,它与强碱溶液共热,发生反应的离子方程式是______________________。
(6)某一反应体系中含有D2E、D2EC3、D2EC4三种物质,若此反应为分解反应,则此反应的化学方程式为________________________(化学式用具体的元素符号表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学与生产及环境密切相关,下列有关说法错误的是( )
A. 日前,我国在南海开采的可燃冰其有效成分为甲烷
B. 氮氧化物和硫的氧化物是形成酸雨的主要物质
C. 导致光化学烟雾的主要物质为二氧化硫
D. 二氧化碳含量的增加会导致温室效应加剧
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是 ( )
A.活化分子间的碰撞一定发生化学反应
B.吸热反应只有加热才能发生
C.有能量变化的一定是化学反应
D.有化学键断裂不一定发生化学反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】反应N2(g)+3H2(g)![]() 2NH3(g)(△H<0)在等容条件下进行。改变其他反应条件,在I、II、III阶段体系中各物质浓度随时间变化的曲线如下图所示:
2NH3(g)(△H<0)在等容条件下进行。改变其他反应条件,在I、II、III阶段体系中各物质浓度随时间变化的曲线如下图所示:

回答问题:
(1)在3个阶段中,N2的平均反应速率![]() (N2)、
(N2)、![]() (N2)、
(N2)、![]() (N2)中最大的是 ,其值是 。
(N2)中最大的是 ,其值是 。
(2)H2的平衡转化率αⅠ(H2)、αⅡ(H2)、αⅢ(H2)的大小关系是 。
(3)由第一次平衡到第二次平衡,平衡移动的方向是 (填“正反应方向”或“逆反应方向”),采取的措施是 。
(4)第Ⅰ阶段时,化学平衡常数K1= ;第Ⅱ、Ⅲ阶段化学平衡常数K2 K3;(填“>、<、=”)判断的理由是 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】焦亚硫酸钠(Na2S2O5)是常用的食品抗氧化剂之一。某研究小组进行如下实验:采用如图装置(实验前已除尽装置内的空气)制取Na2S2O5。已知:① 装置Ⅱ中有Na2S2O5晶体析出,发生的反应为Na2SO3+SO2===Na2S2O5;
② Na2S2O5晶体在空气中被氧化生成Na2SO4。
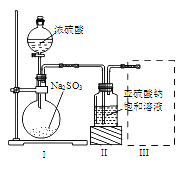
(1) 装置Ⅰ中产生气体的化学方程式为:_____________________________。
(2) 要从装置Ⅱ中获得已析出的晶体,可采取的分离方法是 。
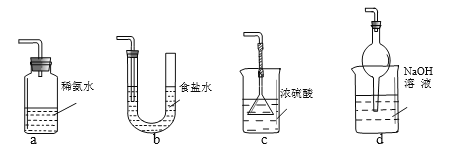
(3) 装置Ⅲ用于处理尾气,可选用右图中最合理装置(夹持仪器已略去)为___________(填序号)。
(4)检测Na2S2O5晶体在空气中已被氧化的实验方案是: 。
(5)为了研究Cl2与SO2的在干燥条件下发生反应及进行的程度。用右下图所示装置收集满干燥的Cl2,再通入干燥的SO2,集气瓶中立即出现无色液体SO2Cl2; 充分反应后,将液体和剩余气体分离。用除尽空气的NaOH溶液吸收分离出的气体,用足量稀盐酸酸化后,再滴加BaCl2溶液,产生白色沉淀,该白色沉淀是 ,由此可知反应后剩余的气体为Cl2和 ,综合实验信息,干燥的SO2与Cl2反应的化学方程式为 。

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com