
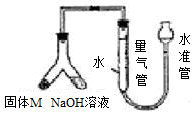
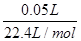 =
=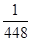 mol。所以根据方程式2Al+2OH-+2H2O=2AlO2-+3H2↑可知最多消耗率的质量=
mol。所以根据方程式2Al+2OH-+2H2O=2AlO2-+3H2↑可知最多消耗率的质量=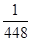 mol×
mol×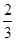 ×27g/mol=0.04g,因此固体M中铝的质量(m)范围为0<m<0.04g。
×27g/mol=0.04g,因此固体M中铝的质量(m)范围为0<m<0.04g。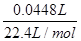 =0.002mol,所以消耗铝的质量=0.002mol×
=0.002mol,所以消耗铝的质量=0.002mol×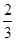 ×27g/mol=0.036g=36mg。则合金中铝的质量分数=
×27g/mol=0.036g=36mg。则合金中铝的质量分数=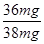 ×100%=94.74%>78%,所以符合国家标准。
×100%=94.74%>78%,所以符合国家标准。

 全优点练单元计划系列答案
全优点练单元计划系列答案科目:高中化学 来源:不详 题型:单选题
| A.3.2 g | B.4.0 g | C.4.2 g | D.4.6 g |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
| 沉淀物 | 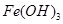 | 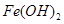 | 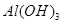 |
| 开始沉淀 | 2.3 | 7.5 | 3.4 |
| 完全沉淀 | 3.2 | 9.7 | 4.4 |
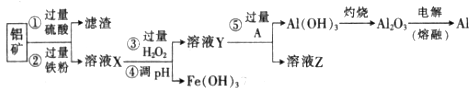
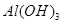 时,用到多种硅酸盐质的仪器,除玻璃棒、酒精灯、泥三角外,还有___________(填仪器名称)。
时,用到多种硅酸盐质的仪器,除玻璃棒、酒精灯、泥三角外,还有___________(填仪器名称)。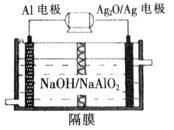
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
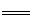 2K2SO4+2Al2O3 +9SO2 +48H2O,下列判断正确的是
2K2SO4+2Al2O3 +9SO2 +48H2O,下列判断正确的是| A.在焙烧明矾的反应中,还原剂与氧化剂的物质的量之比是3:4 |
| B.最后得到的K2SO4溶液呈中性,所以c(K+)=c(SO42-) |
| C.焙烧产生的SO2可用于制硫酸,焙烧948 t明矾(M=" 474" g/mol),若SO2的利用率为96%,可生产质量分数为98%的硫酸432 t |
| D.工业上冶炼Al2O3制得Al,以Al和NiO(OH)为电极,NaOH溶液为电解液组成一种新型电池,放电时NiO(OH)转化为Ni(OH)2,该电池反应的化学方程式是 |
 NaAlO2+3Ni(OH)2
NaAlO2+3Ni(OH)2查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.②③④ | B.①②④ | C.①②③④ | D.①③④ |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
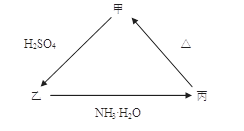
 丙的离子方程式______________________; 丙
丙的离子方程式______________________; 丙 甲的化学方程式____________________。
甲的化学方程式____________________。 乙的离子方程式是_____________________________。
乙的离子方程式是_____________________________。查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题
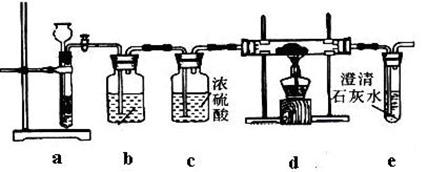
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.①② | B.②③⑤ | C.①②④⑤ | D.全部 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
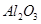 ,含
,含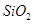 、
、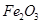 、MgO等杂质)中提取两种工艺品的流程如下:
、MgO等杂质)中提取两种工艺品的流程如下: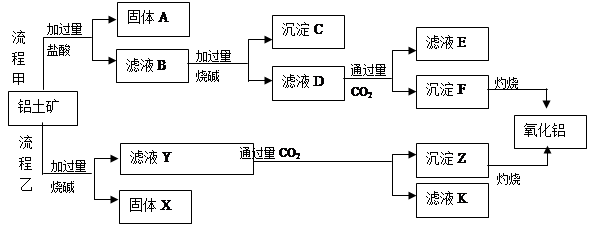
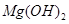 的溶度积常数
的溶度积常数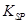 =10-11,取适量的滤液B,加入一定量的烧碱恰使镁离子沉淀完全,则溶液的PH最小为_______.
=10-11,取适量的滤液B,加入一定量的烧碱恰使镁离子沉淀完全,则溶液的PH最小为_______.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com