
(14分)A、B代表不同物质,都是H、N、O、Na中的任意三种元素组成的强电解质,A的水溶液呈碱性,B的水溶液呈酸性,请找出A、B可能的两种组合。(要求:相同浓度时,A1溶液中水的电离程度小于A2溶液中水的电离程度;相同浓度时,B1溶液中水的电离程度小于B2溶液中水的电离程度.)
(1)写出化学式:A1________,A2________,B1________,B2________;
(2)相同温度下,当A1、B1的物质的量浓度相等时,两溶液中水电离出的氢离子的物质的量浓度之比为____________;常温下,若B1、B2两溶液的pH=5,则两溶液中由水电离出的氢离子的物质的量浓度之比为________;
(3)写出0.1 mol/L的A2溶液中离子浓度大小排序______________________________。
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源:2014-2015山西省原平市高二上学期期末考试化学试卷(解析版) 题型:选择题
下列属于强电解质的是
A.Cu B.CH3COONH4 C.CH3COOH D.NH3·H2O
查看答案和解析>>
科目:高中化学 来源:2014-2015黑龙江省鸡西市龙东南七校高一上学期期末联考化学试卷(解析版) 题型:选择题
铁和氧化铁的混合物共2mol,加盐酸后固体全部溶解,共收集到0.5molH2,且溶液中加入KSCN溶液不显红色,则原混合物中铁的物质的量为
A.0.5mol B.1.5mol C.0.75mol D.1.25mol
查看答案和解析>>
科目:高中化学 来源:2014-2015学年福建省漳州市八校高三3月联考理综化学试卷(解析版) 题型:填空题
选考(化学-物质结构与性质)(13分)
(1)基态铬原子的价电子排布式为 。
(2)CrO2Cl2和NaClO均可作化工生产的氧化剂或氯化剂。制备CrO2Cl2的反应为:
K2Cr2O7+3CCl4===2KCl+2CrO2Cl2+3COCl2↑。
上述反应式中非金属元素电负性由大到小的顺序是 (用元素符号表示)。
(3)随着人们生活质量的提高,室内的环境安全和食品安全越来越为人们所关注。甲醛(HCHO)是室内主要空气污染物之一(其沸点是–19.5 ℃),甲醇(CH3OH)是“假酒”中的主要有害物质(其沸点是64.65 ℃),甲醇的沸点明显高于甲醛的主要原因是 。
(4)双氰胺结构简式如图所示。

①双氰胺分子中σ键和π键数目之比为 。
②双氰胺分子碳原子的杂化类型为 。
(5)镍元素能形成多种配合物,配离子[Ni(CN)4]2+中不含有的作用力是 (填选项编号)。
A.离子键
B.配位键
C. 键
键
D. 键
键
E.氢键
(6)科研人员研究出以钛酸锶为电极的光化学电池,用紫外线照射钛酸锶电极,使水分解产生氢气。已知钛酸锶晶胞结构如图所示,则其化学式为 。

查看答案和解析>>
科目:高中化学 来源:2014-2015学年福建省漳州市八校高三3月联考理综化学试卷(解析版) 题型:选择题
下图是部分短周期主族元素原子半径与原子序数的关系图。则下列说法正确的是

A.Y、R两种元素的气态氢化物及其最高价氧化物的水化物均为强酸
B.简单离子的半径:X > Z > M
C.由X与N两种元素组成的化合物不能与任何酸反应,但能与强碱反应
D.Z单质能从M与R元素构成的盐溶液中置换出单质M
查看答案和解析>>
科目:高中化学 来源:2014-2015黑龙江省高二上学期期末考试化学试卷(解析版) 题型:选择题
电化学降解NO3-的原理如图所示,若电解过程中转移了2mol电子,则膜两侧电解液的质量变化差(Δm左-Δm右)为a克,则a值为
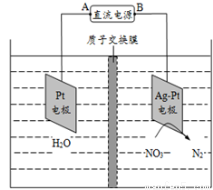
A.14.4 B.10.4 C.12.4 D.14.0
查看答案和解析>>
科目:高中化学 来源:2014-2015黑龙江省高二上学期期末考试化学试卷(解析版) 题型:选择题
对于可逆反应:2SO2(g)+O2(g)  2SO3(g) ΔH<0,下列研究目的和示意图相符的是
2SO3(g) ΔH<0,下列研究目的和示意图相符的是
A | B | C | D | |
研究目的 | 压强对反应的影响(p2>p1) | 温度对反应的影响 | 平衡体系增加O2的浓度对反应的影响 | 体积恒定的密闭容器中催化剂对反应的影响 |
示 意 图 |
|
|
|
|
查看答案和解析>>
科目:高中化学 来源:2014-2015学年上海市十三校高三第二次联考化学试卷(解析版) 题型:计算题
(本题共14分)铜有多种化合物,氧化亚铜(Cu2O)、氯化亚铜(CuCl)、氯化铜(CuCl2)、CuSO4等。
完成下列计算:
(1)波尔多液是由硫酸铜、生石灰和水配制成的杀菌剂,不同情况下需要配制不同的比例。现配制按质量比CuSO4:CaO:H2O =1:2:200的波尔多液50Kg。
需要用CuSO4·5H2O g,CaO mol
(2)某工厂以精辉铜矿(主要成分为Cu2S)为原料冶炼金属铜,精辉铜矿中含23%杂质,日均产含Cu量97.5%的粗铜42t。
已知:总反应式 Cu2S+O2 2Cu+SO2
2Cu+SO2
日均需精辉铜矿 t,日均产SO2标准状况下体积 L
(3)印刷线路板的铜能被FeCl3的溶液腐蚀,将印刷线路板浸入200mL FeCl3溶液中,有11.2g Cu被腐蚀掉。取出印刷线路板,向溶液中加入11.2g铁粉,充分反应溶液中还有4.8g不溶物。计算原FeCl3溶液的物质的量浓度。
(4)制备铜的某化合物晶体。取5.12g Cu、14.5mol/L HNO3 15 mL、6.0 mol/L HC1 50mL,混合后Cu完全反应,反应后溶液有中水54.32g,再经水浴保温蒸发掉42g水,冷却至20℃并过滤,得到8.12g晶体。通过计算推断此晶体的化学式 。
已知:20℃溶解度 CuC12·2H2O 73g /100g H2O Cu(NO3)2·3H2O 125g /100g H2O
查看答案和解析>>
科目:高中化学 来源:2014-2015学年北京市顺义区高三第一次统一练习化学试卷(解析版) 题型:选择题
下列叙述不正确的是
A.植物油的不饱和程度高于动物油,植物油更易氧化变质
B.除去乙酸乙酯中少量的乙酸:用饱和碳酸钠溶液洗涤、分液
C.过氧化钠中含有离子键和非极性共价键,阴离子与阳离子的物质的量之比为1:1
D.向某溶液中滴入稀盐酸产生使澄清石灰水变浑浊的气体,该溶液不一定含有CO32-
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com