
| A. | $\frac{a}{A+n}$mol | B. | $\frac{a}{A}$mol | C. | $\frac{(A-N+m)a}{A+m}$mol | D. | $\frac{a}{A}$mol |
分析 X原子的质量数为A,含N个中子,则质子数为A-N,结合n=$\frac{m}{M}$计算.
解答 解:HmX的相对分子质量为A+m,a g HmX分子的物质的量为n=$\frac{ag}{(A+m)g/mol}$=$\frac{a}{A+m}$mol,X原子的质量数为A,含N个中子,则质子数为A-N,所以在a g HmX分子中含质子的物质的量为$\frac{a}{A+m}$mol×(A-N+m)=$\frac{(A-N+m)a}{A+m}$mol,
故选C.
点评 本题考查物质的量的计算,为高频考点,把握质量、物质的量、物质构成为解答的关键,侧重分析与计算能力的考查,注意H的质子数为1、X的质子数为A-N,题目难度不大.


科目:高中化学 来源: 题型:解答题
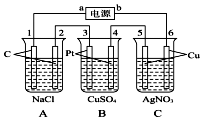 如图,通电5min后,电极5的质量增加2.16g,回答:
如图,通电5min后,电极5的质量增加2.16g,回答:查看答案和解析>>
科目:高中化学 来源: 题型:实验题
| 实验步骤 | 解释或实验结论 |
| (1)称取A9.0g,升温使其汽化,测其密度是相同条件下H2的45倍. | 试通过计算填空: (1)A的相对分子质量为:90. |
| (2)将此9.0gA在足量纯O2充分燃烧,并使其产物依次缓缓通过浓硫酸、碱石灰,发现两者分别增重5.4g和13.2g. | (2)A的分子式为:C3H6O3. |
| (3)另取A 9.0g,跟足量的NaHCO3粉末反应,生成2.24LCO2(标准状况),若与足量金属钠反应则生成2.24LH2(标准状况). | (3)该有机物分子中含有羟基、羧 基各1mol,羟基的电子式为 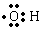 . . |
(4)A的核磁共振氢谱如图: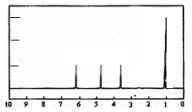 | (4)A中含有4种氢原子. |
(5)综上所述,A的结构简式 , , | |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 25℃时,NH3•H2O的电离平衡常数Kb=1.75×10-5,该温度下,用0.01mol•L-1 盐酸测定10mLxmol•L-1氨水.溶液pH随V[(HCl)aq]变化曲线如图所示.下列说法正确的是( )
25℃时,NH3•H2O的电离平衡常数Kb=1.75×10-5,该温度下,用0.01mol•L-1 盐酸测定10mLxmol•L-1氨水.溶液pH随V[(HCl)aq]变化曲线如图所示.下列说法正确的是( )| A. | 原氨水浓度x=0.01mol•L-1 | |
| B. | m、p两点溶液中由水电离出来的c(OH-):m>p | |
| C. | n点溶液中:c(Cl-)>c(NH4+)>c(OH-)>c(H+) | |
| D. | 若在m点溶液中加少量水,[c(NH3•H2O)•c(H+)]/c(NH4+)不变 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
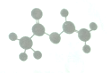 法国、美国、荷兰的三位科学家因研究“分子机器的设计与合成”获得2016年诺贝尔化学奖:轮烷是一种分子机器的一种分子机器的“轮子”,轮烷的一种合成原料由C、H、O三种元素组成,其球棍模型如图所示,下列说法正确的是( )
法国、美国、荷兰的三位科学家因研究“分子机器的设计与合成”获得2016年诺贝尔化学奖:轮烷是一种分子机器的一种分子机器的“轮子”,轮烷的一种合成原料由C、H、O三种元素组成,其球棍模型如图所示,下列说法正确的是( )| A. | 该化合物的名称为乙酸乙酯 | |
| B. | 该化合物可使溴的四氯化碳溶液、酸性高锰酸钾溶液褪色,且反应类型相同 | |
| C. | 该化合物既能发生取代反应,又能发生加成反应和氧化反应 | |
| D. | 该化合物的同分异构体中,能与NaHCO3反应放出CO2的只有2种 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①② | B. | ②③ | C. | ④ | D. | ①④ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 6.4g铜在足量的氯气中燃烧,转移的电子数为0.1NA | |
| B. | 标准状况下,2.24L乙醇中含有的氧原子数为0.1NA | |
| C. | 2.0gH218O与D216O的混合物中所含质子数为NA | |
| D. | 0.1L0.5 mol•L-1CH3COOH溶液中含有的H+数为0.05NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com