
【题目】气体是物质聚集状态的重要形式之一,在实验室或工业上经常需制备气体。以下是某同学设计的实验室制备氨气的一些装置。
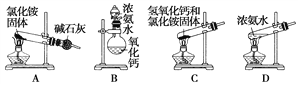
(1)上面是实验室制取氨气的装置和选用的试剂,其中不能得到氨气的是________(填字母)。
(2)利用装置B和下列提供的试剂,能制备的下列气体有________________(填气体的化学式)。
气体 | 所用试剂 |
SO2 | NaHSO3(固)+H2SO4(浓) |
Cl2 | MnO2(固)+HCl(浓) |
H2S | Na2S(固)+H2SO4(浓) |
O2 | Na2O2 (固)+H2O |
(3)实验室制备、收集干燥的NO2,所需仪器如图所示,按气流方向连接各仪器接口,顺序为a→________→________→________→________→f。装置D的作用是__________________________,装置E中盛放的溶液是________。制备时,烧瓶中装少量铜片,从分液漏斗向烧瓶中滴加浓硝酸,烧瓶中的现象是__________________________________________________________________。
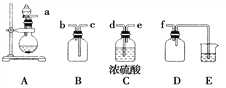
【答案】 AC SO2、O2 d e c b 防止E中的溶液倒吸到B中 NaOH溶液 铜片和浓硝酸剧烈反应,产生大量红棕色气体,得到绿色溶液,铜片逐渐溶解
【解析】(1)氯化铵加热不能用于制备氨气,因为它分解生成的氨气与氯化氢遇冷又化合生成氯化铵;装置C试管口向上,可能会造成试管炸裂;装置B符合固体与液体不加热反应制备气体。答案选AC;(2)NaHSO3(固)和H2SO4(浓)混合可以制备SO2,二氧化锰与浓盐酸需要加热才能产生氯气,浓硫酸具有强氧化性,不能与硫化钠反应制备H2S,过氧化钠与水反应可以制备氧气;(3)收集二氧化硫应先干燥再收集,二氧化硫的密度比空气大,要从c口进气,最后进行尾气处理.因为二氧化硫易于氢氧化钠反应,故D的作用是安全瓶,防止倒吸,所以连接顺序是adecbf;根据以上分析可知装置D的作用是防止E中的溶液倒吸到B中;二氧化硫有毒,需要尾气处理,所以装置E中盛放的溶液是NaOH溶液;浓硝酸具有强氧化性,与金属铜反应的实验现象是:铜片和浓硝酸剧烈反应,产生大量红棕色气体,得到绿色溶液,铜片逐渐溶解。


 第1卷单元月考期中期末系列答案
第1卷单元月考期中期末系列答案科目:高中化学 来源: 题型:
【题目】ClO2(其中氧元素为-2价)是一种消毒杀菌效率高、二次污染小的水处理剂。实验室中可通过以下反应制得ClO2:2KClO3+H2C2O4+H2SO4![]() 2ClO2↑+K2SO4+2CO2↑+2H2O。
2ClO2↑+K2SO4+2CO2↑+2H2O。
(1)该反应中氧化剂是__________。
(2)当收集到标况下气体22.4L时,求参加反应的H2C2O4质量和物质的量__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知乙酸乙酯(C4H8O2)是一种无色液体,不溶于水,密度小于1 g·mL-1,沸点约为55 ℃。要从水与乙酸乙酯的混合物中将乙酸乙酯分离出来,下列方法中最简便的是
A.蒸馏B.分液C.过滤D.蒸发
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以CO和H2为原料生产二甲醚(CH3OCH3)主要发生以下三个反应

(1)该工艺的总反应为3CO(g)+3H2(g) ![]() CH3OCH3(g)+CO2(g)△H
CH3OCH3(g)+CO2(g)△H
该反应△H=_______________,化学平衡常数K=__________(用含K1、K2、K3的代数式表示)。
(2)某温度下,将8.0molH2和4 molCO充入容积为2L的密闭容器中,发生反应:4H2(g)+2CO(g) ![]() CH3OCH3(g)+H2O(g),5分钟后反应达平衡,测得二甲醚的体积分数为1/6,则用CH3OCH3的浓度变化表示该反应的速率为__________mol·L—1min—1,CO的转化率为_________。
CH3OCH3(g)+H2O(g),5分钟后反应达平衡,测得二甲醚的体积分数为1/6,则用CH3OCH3的浓度变化表示该反应的速率为__________mol·L—1min—1,CO的转化率为_________。
(3)下列措施中,既能加快反应速率又能提高CH3OCH3产率的有___________。
A.分离出二甲醚 B.升高温度 C.改用高效催化剂 D.增大压强
(4)该工艺中反应③的发生提高了CH3OCH3的产率原因是_________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】能源“非石油化”是战略目标,发展以CH4、CO2等为原料的“C1化学”成为当今化工生产的必然趋势。通常天然气中含有H2S等有毒气体,下面为天然气合成氨的工艺流程。
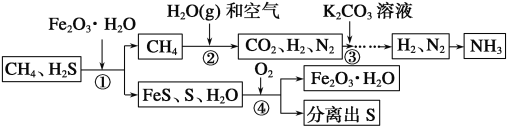
(1)合成氨的原料之一为氮气,该流程中为合成氨提供氮气的物质是__________。
(2)①处加入Fe2O3·H2O的目的是__________。
(3)②处CH4与H2O(g)反应生成CO2、H2,反应的化学方程式是_________________________。
(4)③处一般加入K2CO3溶液以吸收CO2,K2CO3溶液与CO2反应生成碳酸氢钾(KHCO3),该反应的化学方程式是________________________。
(5)该流程中参与循环的物质是__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图为某反应的微观模拟示意图。
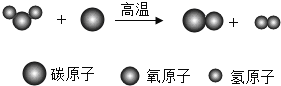
(1)图中的氧化物有________种。
(2)该反应的化学方程式为_________________________,属于_____________(填基本反应类型)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学反应原理对生产有重大的指导意义。回答下列问题:
(1)有两个温度相同的密闭容器A和B,容器A保持容积不变,容器B保持压强不变,起始时向容积相等的A、B中分别充入等量的C(碳)和H2O(g),发生反应:C(s)+H2O(g)![]() CO(g)+ H2(g) (正反应为吸热反应),并分别达到平衡。
CO(g)+ H2(g) (正反应为吸热反应),并分别达到平衡。
①H2O的体积分数:V(A)%_____V(B)%。(填“>”、“<” “=”)
②达到平衡后,在两容器中分别通入等量的氦气,则A中H2O的转化率_______(填“增大” “减小”、“不变”);B中化学平衡_________移动(填“不”“向正反应方向”“向逆反应方向”)。
(2)某温度下,测得0.01mol·L-1 NaOH溶液的pH=10,则在该温度下Kw=______;在此温度下,将pH=11的NaOH溶液aL与pH=2的H2SO4溶液bL混合,若所得溶液为中性,则a:b=_______(假设混合时体积不变)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图一所示装置中,甲、乙、丙三个烧杯依次分别盛放100g 5.00%的NaOH溶液,足量的CuSO4溶液和100g 10.00%的K2SO4溶液,电极均为石墨电极。
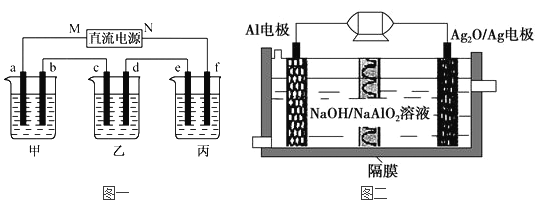
(1)图一中的直流电源为一种性能优良的Al-Ag2O电池,其原理如图二所示。该电池中铝是负极,试写出电池工作时的正极反应式__________________和电池的总化学反应方程式______________。
(2)接通电源后,经过一段时间后,测得丙中K2SO4质量分数为10.47%,乙中c电极质量增加。据此回答问题:
①电源的N端为_______极;c电极上发生______反应(“氧化”或“还原”);
②电极b上发生的电极反应为___________________;
③列式计算电极b上生产的气体在标准状况下的体积_______;
④电极c的质量变化是_____g;
⑤电解前后各溶液的pH是否发生变化(“增大”、“减小”或“不变”)
甲溶液_________;乙溶液_________;丙溶液______________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com