
| A. | 醋酸钠中加入盐酸:CH3COONa+H+→CH3COOH+Na+ | |
| B. | 在硫酸作催化剂、加热条件下乙烯与水发生加成反应:CH2═CH2+H2O $→_{△}^{H_{2}SO_{4}}$ CH3CH2OH | |
| C. | 甲醛溶液中加入足量的银氨溶液并加热: HCHO+2[Ag(NH3)2]++2OH-$\stackrel{水浴加热}{→}$HCOO-+NH4++2Ag↓+3NH3+H2O | |
| D. | 2分子甘氨酸 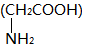 在一定条件下脱去2分子水: 在一定条件下脱去2分子水: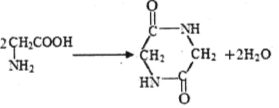 |
分析 A.醋酸为强电解质,应拆成离子形式,醋酸为弱酸,保留化学式;
B.乙烯与水加成生成乙醇;
C.甲醛中含2个-CHO,发生银镜反应生成碳酸铵、银、氨气和水;
D.氨基与羧基脱水生成肽键,2分子脱水形成环状结构.
解答 解:A.醋酸为强电解质,应拆成离子形式,醋酸为弱酸,保留化学式,离子方程式:CH3COO++H+→CH3COOH,故A错误;
B.在硫酸作催化剂、加热条件下乙烯与水发生加成反应:CH2═CH2+H2O $→_{△}^{H_{2}SO_{4}}$ CH3CH2OH,故B正确;
C.甲醛中含2个-CHO,发生银镜反应生成碳酸铵、银、氨气和水,离子反应为HCHO+4[Ag(NH3)2]++4OH-$\stackrel{△}{→}$CO32-+2NH4++4Ag↓+6NH3+2H2O,故C错误;
D.2分子甘氨酸 脱去2分子水的反应为
脱去2分子水的反应为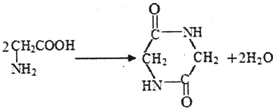 ,故D正确;
,故D正确;
故选:AC.
点评 本题考查离子方程式、化学方程式的书写,为高频考点,明确官能团及其性质关系是解本题关键,知道常见有机物反应类型及特点、断键和成键方式,难点是甲醛和银氨溶液反应方程式的书写.


 口算心算速算应用题系列答案
口算心算速算应用题系列答案 同步拓展阅读系列答案
同步拓展阅读系列答案科目:高中化学 来源: 题型:解答题
| t℃ | 700 | 800 | 830 | 1000 | 1200 |
| K | 1.7 | 1.1 | 1.0 | 0.6 | 0.4 |
| 实验组 | 温度/℃ | 起始量/mol | 平衡量/mol | 达到平衡所需时间/min | ||
| H2O | CO | CO2 | CO | |||
| A | 650 | 2 | 4 | 1.6 | 2.4 | 5 |
| B | 900 | 1 | 2 | 0.4 | 1.6 | 3 |
| C | 900 | a | b | c | d | t |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题

查看答案和解析>>
科目:高中化学 来源:2016-2017学年甘肃省高二上10月月考化学试卷(解析版) 题型:选择题
将 浓度为0.1 mol·L-1 HF
浓度为0.1 mol·L-1 HF 溶液加水不断稀释,下列各
溶液加水不断稀释,下列各 量始终保持增大的是( )
量始终保持增大的是( )
A.c(H+) B.Ka(HF)
C.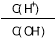 D.
D.
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 温度/°C | 1000 | 1150 | 1300 |
| 平衡常数 | 4.0 | 3.7 | 3.5 |
| A. | △H>0 | |
| B. | 1000℃时,在固定体积的密闭容器中,某时刻测得上述体系中,CO、CO2的物质的量分别为0.5mol、1.8mol,此时反应向正反应方向进行 | |
| C. | 其他条件不变,向平衡体系充入CO2气体,K值减小 | |
| D. | 其他条件不变,升高温度,可以提高CO的平衡转化率 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
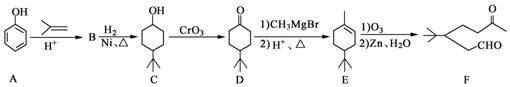
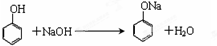 .
. ,A到B的反应类型为加成反应.
,A到B的反应类型为加成反应. (任写一种).
(任写一种).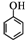 )和CH2=CH2为原料制备有机物 的
)和CH2=CH2为原料制备有机物 的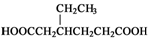 合成路线流程图(无机试剂任用).
合成路线流程图(无机试剂任用).查看答案和解析>>
科目:高中化学 来源: 题型:实验题
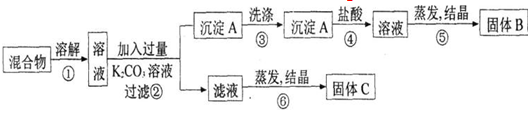
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| T/K | 298 | 398 | 498 |
| 平衡常数K | 4.1×106 | K1 | K2 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com