
| A. | 黏土 | B. | 纯碱 | C. | 石灰石 | D. | 熟石灰 |
科目:高中化学 来源: 题型:选择题
| A. | 标准状况下,5.6L CO2与足量Na2O2反应转移的电子数为0.5NA | |
| B. | 2L 0.5 mol•L-1 亚硫酸溶液中含有的H+数为2NA | |
| C. | 分子总数为NA的SO2和CO2混合气体中含有的氧原子数为2NA | |
| D. | 1mol FeI2与足量氯气反应时转移的电子数为2NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 向硝酸银溶液中加盐酸:Ag++Cl-═AgCl↓ | |
| B. | 碳酸氢钙溶液跟盐酸反应:Ca(HCO3)2+2H+═Ca2++2H2O+2CO2↑ | |
| C. | 盐酸跟氢氧化镁反应:H++OH-═H2O | |
| D. | 碳酸镁跟硫酸反应:MgCO3+H+═Mg2++H2O+CO2↑ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 16g氧气所含的氧原子数为2NA | |
| B. | 18g水所含的电子数为NA | |
| C. | 2.4g金属镁与盐酸(足量)反应失去的电子数为0.1NA | |
| D. | 17g氨气所含电子数目为10NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
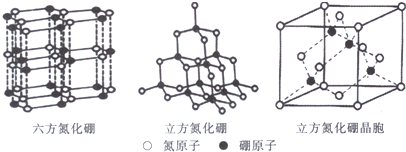
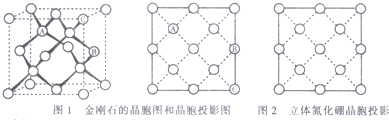
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氮肥NH4NO3在重力撞击下可能发生爆炸 | |
| B. | 在食品袋中放入盛有硅胶的透气小袋,可防止食物受潮 | |
| C. | SO2可以用来漂白纸浆、毛、丝、草帽辫、增白食品等 | |
| D. | 碳酸氢钠可用来治疗胃酸过多 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
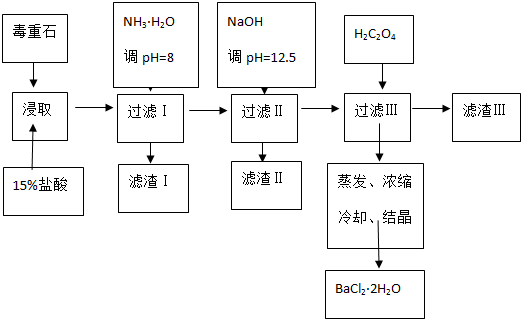
| Ca2+ | Mg2+ | Fe3+ | |
| 开始沉淀时的pH | 11.9 | 9.1 | 1.9 |
| 完全沉淀时的pH | 13.9 | 11.1 | 3.2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 室温下,pH=1的溶液中:K+、Fe2+、ClO-、SO42- | |
| B. | $\frac{c({H}^{+})}{c(O{H}^{-})}$=1×1012的溶液:Cu2+、Na+、SO42-、NO3- | |
| C. | 加入铝粉产生大量氢气的溶液中:Na+、NH4+、NO3-、SO42- | |
| D. | 在0.1 mol•L-1 Fe3+溶液中:K+、Na+、HCO3-、SO42- |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com