
| A. | 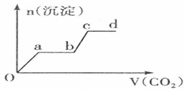 | B. | 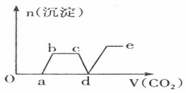 | ||
| C. | 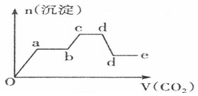 | D. | 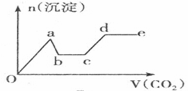 |
分析 只要通入CO2,立刻就有沉淀BaCO3产生;将Ba(OH)2消耗完毕,接下来消耗KOH,因而此段不会产生沉淀(即沉淀的量保持不变);KOH被消耗完毕,接下来消耗KAlO2,有Al(OH)3沉淀生成;又因二氧化碳足量,还可以继续与上面反应的产物K2CO3、BaCO3反应,据此进行判断.
解答 解:足量的CO2气体不断通人到含KOH、Ba(OH)2、KAlO2的混合溶液中,二氧化碳先与氢氧化钡反应生成碳酸钡沉淀,所以一开始就会产生沉淀,消耗完氢氧化钡后,再与氢氧化钾溶液反应,生成碳酸钾和水,此段不会产生沉淀图象为平台;
氢氧化钾消耗完后,二氧化碳在于KAlO2反应生成氢氧化铝沉淀,沉淀物质的量增加;
消耗完KAlO2,再与溶液中生成的碳酸根离子反应生成碳酸氢根离子,此段不会产生沉淀图象为平台;
然后再与碳酸钡反应生成碳酸氢钡,部分沉淀溶解,沉淀物质的量减少;
最后通入二氧化碳,沉淀质量不变,为平台;
符合上述关系的图象为C,
故选:C
点评 本题以图象为载体,考查了二氧化碳通入混合溶液中的反应顺序,明确每段发生的反应是解题关键,题目难度中等.


 口算心算速算应用题系列答案
口算心算速算应用题系列答案 同步拓展阅读系列答案
同步拓展阅读系列答案科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 加入BaCl2溶液产生不溶于稀HNO3的白色沉淀,说明原溶液中有SO42- | |
| B. | 加入盐酸,生成的气体能使澄清石灰水变浑浊,可确定有CO32-存在 | |
| C. | 验证烧碱溶液中是否含有Cl-,先加稀硝酸除去OH-,再加入AgNO3溶液,有白色沉淀,证明含Cl- | |
| D. | 加入NaOH溶液有白色沉淀出现,则原溶液中一定含有Mg2+ |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 达到化学平衡时,5v正(O2)=4v逆(NO) | |
| B. | 若单位时间内生成x mol NO,同时消耗x mol NH3,则可确定反应达到平衡状态 | |
| C. | 达到化学平衡时,若增大容器的体积,则正反应速率减小,逆反应速率也减小 | |
| D. | 化学反应速率的关系是2v正(NH3)=3v正(H2O) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | P-P键的键能大于P-Cl键的键能 | |
| B. | 可求Cl2(g)+PCl3(g)═PCl5(s)的反应热△H | |
| C. | Cl-Cl键的键能$\frac{b-a+5.6c}{4}$ kJ•mol-1 | |
| D. | 1molP4含4molp-p键 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 多余的氯气可以用氢氧化钠溶液吸收 | |
| B. | 用澄清的石灰石可以鉴别CO2和SO2 | |
| C. | SO2、Cl2都能使品红溶液褪色,其原理不同 | |
| D. | 铁丝在氯气中燃烧生成三价铁 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com